Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Образование общей электронной пары.Статьи и работы по химии / Атомно-молекулярное учение и его законы / Химическая связь и строение молекул. / Статьи и работы по химии / Атомно-молекулярное учение и его законы / Химическая связь и строение молекул. / Образование общей электронной пары. Образование общей электронной пары.Страница 5
Cl* 3d Cl** 3d
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 3p 3p
3p 3p
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 3s 3s
3s 3s
![]()
![]()
![]()
![]()
![]() Cl*** 3d
Cl*** 3d
![]()
![]()
![]() 3p
3p
![]()
![]()
![]()
![]()
![]()
![]() 3s
3s
Поэтому атом хлора, в отличие от атома фтора, может принимать участие в образовании не только одной, но также трёх, пяти или семи ковалентных связей. Так, в молекуле хлорноватистой кислоты HClO атом хлора образует одну ковалентную связь, в хлористой кислоте HClO2 ¾ три, в хлорноватой кислоте HClO3 ¾ пять, а в молекуле хлорной кислоты HClO4 ¾ семь ковалентных связей.
Прочность ковалентной связи зависит от степени перекрывания электронных облаков неспаренных электронов двух атомов. Перекрывание электронных облаков может происходить в большей или меньшей мере в зависимости от типа орбиталей, участвующих в образовании химической связи.
Если перекрывание двух s-орбиталей принять за единицу, то перекрывание s- и p-орбиталей составит уже 1,7, а двух p-орбиталей ¾ 3. На рис. 4 схематически показано перекрывание орбиталей различного типа.
Область перекрывания электронных облаков находится в поле обоих ядер и характеризуется наиболее высокой электронной плотностью. Чем
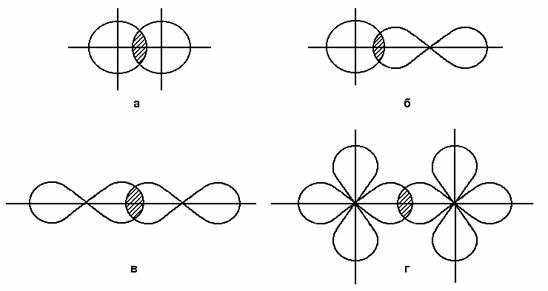 Рис. 4. Схематическое изображение перекрывания s- (а), p- (б), s- и p- (в) и d-орбиталей (г).
Рис. 4. Схематическое изображение перекрывания s- (а), p- (б), s- и p- (в) и d-орбиталей (г).
больше перекрываются облака электронов, образующих общую пару, тем прочнее связаны между собой атомы, тем выше энергия связи.
Смотрите также
Применение каучуков
Фторкаучуки – каучуки
специального назначения, применяемые в производстве изделий и деталей, в
которых должны сочетаться высокая стойкость к действию агрессивных сред и
теплостойкость. Фторкаучуки ...
Контрольные вопросы.
В чем
состоит главная задача химии?
Основанием
химии является основная двуединая проблема химии. В чем она заключается?
От
каких факторов зависят свойства вещества?
Запишите
четыре концеп ...
Активные угли и их промышленное применение
С развитием промышленного производства активного угля
в начале нашего столетия применение этого продукта неуклонно возрастает. В
настоящее время активный уголь используется во многих процесс ...


