Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Образование общей электронной пары.Статьи и работы по химии / Атомно-молекулярное учение и его законы / Химическая связь и строение молекул. / Статьи и работы по химии / Атомно-молекулярное учение и его законы / Химическая связь и строение молекул. / Образование общей электронной пары. Образование общей электронной пары.Страница 3
N O F
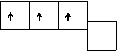
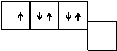
Увеличение числа неспаренных электронов у атомов этих элементов возможно лишь в результате перехода одного из электронов в следующий, M-слой. Затраты энергии, требующиеся для такого перехода, очень велики. Они не компенсируются энергией, выделяющейся при образовании ковалентных связей. Поэтому у атомов названных элементов увеличение числа неспаренных электронов не наблюдается, и за счёт имеющихся в атоме неспаренных электронов атом азота образует три ковалентные связи, атом кислорода ¾ две, а атом фтора ¾ лишь одну связь. Азот, имеющий три неспаренных 2p-электрона, в соединениях с водородом или металлами трехвалентен; кислород, имеющий два неспаренных электрона, двухвалентен, а фтор при взаимодействии с водородом или металлами ведет себя как одновалентный элемент.
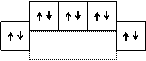
Образование молекул азота и фтора можно представить следующей схемой:
2p 2p
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 2s 2s
2s 2s
N F
 |  |
![]()
![]()
![]()
![]() 2p N 2p F
2p N 2p F
2s 2s
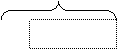
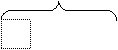
8 электронов 8 электронов
 |  |
 | 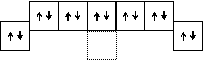 | ||||
8 электронов 8 электронов
N2 F2
В атомах элементов III периода электроны расположены в трёх слоях, причём внешний слой, характеризующийся главным квантовым числом три, содержит электроны лишь на орбиталях 3s и 3p, в то время как M-орбиталь остаётся вакантной. Например, в атомах серы и хлора в невозбуждённом состоянии электроны располагаются следующим образом:
Смотрите также
Обзор и математическое моделирование суспензионной полимеризации тетрафторэтилена
После того, как был получен молекулярный фтор, началось
стремительное развитие методов синтеза, основанных на использовании фтора и
некоторых его простейших соединений как реагентов для заме ...
Получение уксусной кислоты
...
Энтальпия и ее отношение к теплоте химической реакции. Типы химических связей
...


