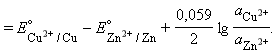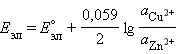Каждый гальванический элемент состоит из двух электродов (окислительно-восстановительных пар), один из которых является поставщиком электронов (анод), а другой их принимает (катод). В гальванических элементах источником электрического тока является химическая реакция. Любая химическая реакция термодинамически разрешена, если ΔG < 0. Из соотношений ΔG = –nFE и ΔG° = –nFE° следует, что электрохимическая реакция, а в общем случае любая окислительно-восстановительная реакция может протекать самопроизвольно, если E > 0 или для стандартных условий E° > 0.
ЭДС гальванического элемента равна разности электродных потенциалов составляющих его электродов. В соответствии с принятой формой записи гальванического элемента его ЭДС равна электродному потенциалу правого электрода (окислителя) минус электродный потенциал левого электрода (восстановителя).
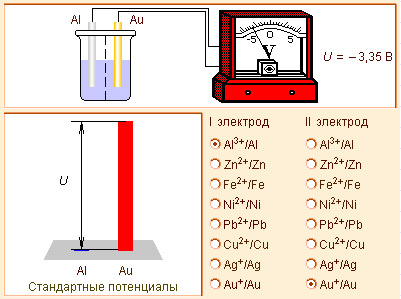
Пользуясь этими соотношениями и таблицей стандартных электродных потенциалов, можно предсказать возможность осуществления многих окислительно-восстановительных реакций.
В случае элемента Даниэля–Якоби (–)Zn¦Zn2+||Cu2+¦Cu(+)
Для нестандартных условий ЭДС элемента Даниеля–Якоби находится из разности электродных потенциалов, вычисленных по уравнению Нернста:
Для реакции
Смотрите также
Заключение
В этом реферате я показал
основные свойства 3-х классов полимеров. Из всего вышеописанного можно ответить
на вопрос: какой полимер можно использовать на производстве для изготовления
того или иного ...
Заключение
В процессе
проделанной работы была рассчитана ректификационная колонна для разделения
смеси бензол–толуол.
В
результате расчета получены данные:
1) &nbs ...
Химические элементы
...