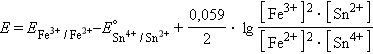Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Химические источники токаОткрытая химия / Химические источники тока / Открытая химия / Химические источники тока / Химические источники тока Химические источники токаСтраница 2
осуществляемой в элементе
| |
|
(7.3) |
Величины электродных потенциалов определяются концентрациями (активностями) всех ионов, участвующих в окислительно-восстановительной реакции. Так, в элементе
| |
протекает реакция
| |
| |
и уравнение Нернста для этого элемента имеет вид:
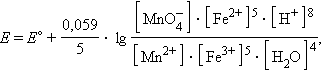 |
| |
Обратите внимание, что в уравнении Нернста для реакции под знаком логарифма в числителе стоят концентрации исходных веществ, а в знаменателе – продуктов реакции в степенях стехиометрических коэффициентов.
|
|
|
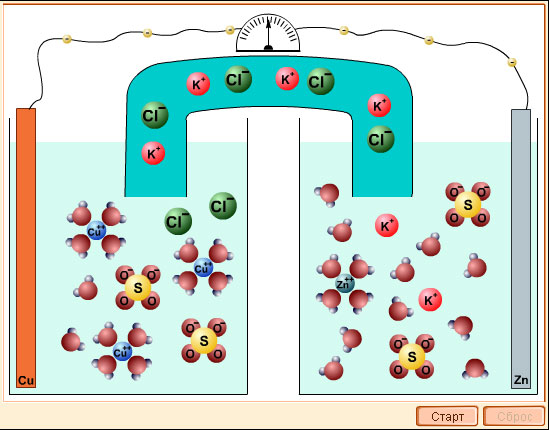
Модель 7.5. Гальванический элемент |
Итак, сопоставляя электродные потенциалы соответствующих систем, можно заранее определить направление, в котором будет протекать окислительно-восстановительная реакция при любых (нестандартных) условиях. Окисленная форма вещества с более высоким потенциалом является окислителем для восстановленных форм с более низким потенциалом.
Однако в большинстве случаев о направлении реакции можно судить по разности стандартных электродных потенциалов ![]() –
– ![]() В случае, когда эта разность близка к нулю, для определения направления реакции используют разность не стандартных, а реальных (с учетом активности ионов) потенциалов, вычисленных по уравнению Нернста.
В случае, когда эта разность близка к нулю, для определения направления реакции используют разность не стандартных, а реальных (с учетом активности ионов) потенциалов, вычисленных по уравнению Нернста.
Равновесное состояние любой окислительно-восстановительной реакции характеризуется нулевой ЭДС (ΔGравн = 0). Тогда из уравнения (7.3) следует
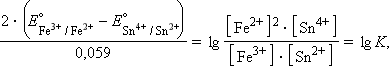 |
то есть представляется возможность определить константу равновесия из электрохимических данных.
При
| |
| |
Смотрите также
Иод
ИОД (лат. Iodium), I - химический элемент VII группы
периодической системы Менделеева,
относится к галогенам (в литературе встречается также символ J); атомный номер
53, атомная масса 126, ...
Производство поливинилбутираля
Химическая
промышленность прошла бурный путь развития в период 50-х – 80-х годов. В
отрасли был создан значительный производственный потенциал. Однако он был
ориентирован на цели командно–а ...