Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Окисление парафиновых углеводородовУчим химию / Учим химию / Окисление парафиновых углеводородов Окисление парафиновых углеводородовСтраница 3
В условиях окисления гидроперекиси могут расходоваться не только при взаимодействии со свободными радикалами и по реакции разветвления, обычно протекающей медленно, но и другими путями, которые для общности называют не цепным расходованием. В некоторых реакциях окисления такой не цепной путь распада оказывается доминирующим. Так, при окислении альдегидов образующаяся над кислота реагирует с исходным альдегидом с образованием кислоты.
В присутствии кислот гидроперекиси подвергаются гетеролитическому расщеплению, что приводит к автоторможению в реакции окисления.
Работами Н.М.Эмануэля [3] показано, что ряд реакций окисления углеводородов прекращаются задолго до полного израсходования исходного вещества.
Вопросы автоторможения реакций окисления подробно изучены Е.Т.Денисовым [40]. Было показано, что в начальный период окисление углеводорода осуществляется за счет взаимодействия RH с перекисными радикалами:
![]()
И скорость реакции определяется концентрацией перекисных радикалов. По мере накопления продуктов окисления - гидроперекисей, спиртов, кетонов, кислот - перекисные радикалы вступают в реакцию взаимодействия с этими продуктами.
При цепном распаде вторичной гидроперекиси радикал R02• заменяется на свободный гидроксил: Реакция RO2• со спиртом приводит к образованию оксигидроперекисного радикала: Реакция с кислотами приводит к выделению СО2 и другому R1O2• радикалу:
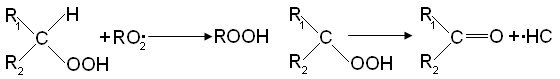
Реакция RO2• со спиртом приводит к образованию оксигидроперекисного радикала:
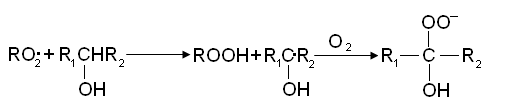
Реакции с кислотами приводит к выделению СО2 и другому R1O2• радикалу:
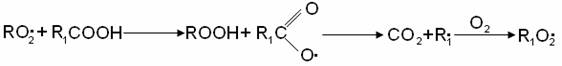
В развившейся реакции исходный углеводород может взаимодействовать с различными свободными радикалами, и скорость его окисления зависит не только от общей концентрации радикалов, но и от их состава. В реальных процессах окисления скорость реакции по ходу изменяется не только в зависимости от скорости вырожденного разветвления цепей , но и в зависимости от состава радикалов.
Специальными исследованиями и кинетическими расчетами было установлена [38], что в сложных цепных реакциях, протекающих с образованием молекулярных промежуточных продуктов, состав радикалов неизбежно меняется в ходе реакции вследствие изменения состава продуктов. Изменяющийся состав радикалов воздействует не только на суммарную активность радикалов, но и на их общую концентрацию путем изменения скорости квадратного обрыва цепей. Таким образом, механизм воздействия состава радикалов на скорость сложной цепной реакции таков, что ускорения реакции всегда ограничено, а её замедления может быть сколь угодно сильным. Это обстоятельство и является фундаментальной причиной широко распространенного явления самоторможения реакций окисления.
Продукты распада радикала R02 были обнаружены при жидкофазном окислении н. бутана, изопропилбензола и циклогексана в металлических реакторах.
Интересным представляется наблюдение [3]. О том, что в металлических реакторах продукты, образующейся с разрывом углеродного скелета в случае окисления бутана, составляют около 10-12% от прореагировавшего бутана, тогда как при окислении н. декане было обнаружено ни карбонильных соединений, ни спиртов, содержащих в своей молекуле меньшее число атомов углерода, чем исходный декан.
Это на первый взгляд кажется удивительным, поскольку оба углеводорода принадлежат к одному и тому же классу- к парафинам нормального строения. В действительности никакого различия механизмом окисления н. декана и н. бутана не существует, а наблюдаемое расхождение в составе продуктов этих реакций объясняется, влиянием нержавеющей стали на распад радикала R-2 при проведении процесса в металлических реакторах.
Смотрите также
Газификация углей
В связи со сложной экологической ситуацией
современная технология ищет новых
решений химических,
энергетических проблем, проблем добычи природных ископаемых.
...
Характеристика кобальта
Кобальт (лат. Cobaltum), Со, Название металла произошло от немецкого
Kobold - домовой, гном. Соединения кобальта были известны и применялись в
глубокой древности. Сохранился египетский с ...
Химико-токсикологический анализ лекарственных средств, производных фенотиазина
В России и за рубежом, начиная с 1945 г., после обнаружения фармакологической активности N-замещенных производных фенотиазина, было синтезировано большое число
препаратов, обладающих нейролеп ...


