Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Теоретическое обоснование принципа ЖМКООрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Теоретическое обоснование принципа ЖМКО Теоретическое обоснование принципа ЖМКОСтраница 4
Сольватация. В определении свойств жестких и мягких кислот и оснований огромную роль играет растворитель. Поскольку Li+ - жесткая кислота, мы говорим, что ему должно соответствовать высокое значение НСМО. На самом деле расчет изолированного иона Li+ показывает, что пустая 2s-орбиталь расположена гораздо ниже по энергии, чем орбитали больших по размерам и предположительно более мягких ионов. Подобным образом ВЗМО небольших анионов (OH-, F-) в газовой фазе расположены достаточно высоко, как и следовало ожидать, учитывая сильное отталкивание между злектронами, сконцентрированными в малом объеме. Таким образом, изолированные ионы Li+, OH-, F- имеют орбитальные характеристики, которые мы приписывали мягким системам.
Жесткость малым ионам придает только сольватация протонными растворителями (симбиоз; см. разд. 3.2.2).
Плотная "положительная" сольватная оболочка (например, из молекул воды, ориентированных атомами водорода к иону) протонных растворителей понижает ВЗМО малых анионов. "Отрицательная" сольватная оболочка (молекулы соды ориентированы атомами кислорода к иону) повышает энергию НСМО малых катионов. Следовательно, жесткость малых ионов можно рассматривать как "приобретенную". Кроме того, малые ионы приобретают жесткость в начале кислотно-основной реакции при прямом взаимодействии с партнером, электростатическое поле которого оказывает стабилизирующее влияние, подобно влиянию протонных растворителей.
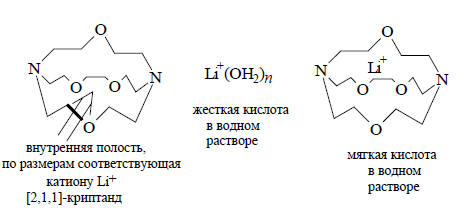
Катион Li+ в водном растворе легко сделать мягкой кислотой, введя его во внутреннюю полость молекулы краун-эфира (см. гл. 11) или криптанда. Тогда, благодаря низкой НСМО, ион Li+ ведет себя так, как будто он изолирован и по размерам больше, чем на самом деле.
Смотрите также
Происхождение и состав нефти
...
Тяжелые металлы
Диагноз массового отравления жителей Рима
свинцом поставлен учеными спустя две тысячи лет. Раскопки показали, что древние
римляне пользовались водопроводной системой и посудой из свинца. Сви ...


