Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Теоретическое обоснование принципа ЖМКООрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Теоретическое обоснование принципа ЖМКО Теоретическое обоснование принципа ЖМКОСтраница 3
Электростатические взаимодействие. Взаимодействие по типу "мягкий-мягкий" можно трактовать как частичный перенос заряда с ВЗМО основания на НСМО кислоты. В этом случае при взаимодействии между кислотой и основанием проявляется орбитальный контроль (ср. разд. 2.3.5, гл. 2). Кулоновское взаимодействие стабилизирует аддукт за счет электростатических сил дальнего действия. Если аддукт стабилен именно из-за кулоновского взаимодействия, а орбитальные взаимодействия играют второстепенную роль, то говорят, что в реакции проявляется зарядовый контроль (разд. 2.3.5, гл. 2). Зарядовый контроль характерен для взаимодействия по типу "жесткий-жесткий" (см. рис. 3.2), когда абсолютные жесткости взаимодействующих молекул велики.
Согласно принципу ЖМКО, жесткие основания (OH-, F-, NH3, RNH2 и т.д.) предпочитают реагировать с жесткими кислотами (H+, Li+, Na+, BF3, AlCl3 и т.д.). Предпочтительность взаимодействия "мягкий-мягкий" понятна: она является следствием сильного взаимодействия ВЗМО-НСМО. Но как объяснить предпочтительность взаимодействия "жесткий-жесткий"? Из уравнения (3.3) следует, что с учетом GA и GB выбор "жесткий-мягкий", казалось бы, предпочтительнее, чем "жесткий-жесткий".
Объяснение состоит в учете степени взаимодействия между ВЗМО и НСМО в данной молекуле кислоты или основания. Жесткое основание имеет электронную пару на низколежащей ВЗМО; эта пара очень трудно поляризуется, так как НСМО основания далеко от ВЗМО этого же основания. Поляризуемость - это степень деформации электронных облаков молекулы под влиянием внешнего поля приближающейся молекулы кислоты. Для легкой деформируемость требуется наличие в данной молекуле близко расположенных ВЗМО и НСМО, легко смешивающихся в результате возмущения. Если пара плохо поляризуема, то это означает, что она прочно удерживается на ВЗМО и создает сильное электростатические поле. Аналогично, если в кислоте первая пустая орбиталь лежит высоко, то электроны на занятых орбиталях также плохо поляризуемы и "плотность пустой орбитали" велика. Таким образом, оба жестких реагента характеризуются низкой поляризуемостью и сильным электростатическим полем.
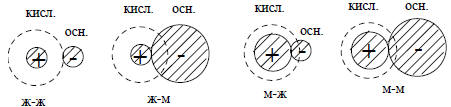
Рис. 3.3. Электростатическое взаимодействие (по Салему) в четырех возможных случаях кислотно-основной нейтрализации. Пунктиром показаны "размеры" НСМО
На рис. 3.3 приведены электростатические взаимодействия для четырех возможных случаев кислотно-основной нейтрализации. При столкновении молекул жесткой кислоты и жесткого основания происходит сильная стабилизация, с избытком компенсирующая слабую стабилизацию, обусловленную взаимодействием граничных орбиталей. Если в реакцию вовлекается мягкий компонент, то диффузная (из-за близости ВЗМО и НСМО) природа его электронной оболочки приводит к уменьшению электростатического притяжения к противоиону. Это связано в тем, что полная энергия притяжения, пропорциональная 1/R, где R - расстояние между зарядами, достигается только тогда, когда ионные сферы не проникают друг в друга, так как по электростатической теореме Гаусса часть отрицательного заряда, которая не находится вне положительной сферы, не будет испытывать полного притяжения этой сферы.


