Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Теоретическое обоснование принципа ЖМКООрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Теоретическое обоснование принципа ЖМКО Теоретическое обоснование принципа ЖМКОСтраница 2
Взаимодействие граничных орбиталей. В реакции донора электронов (основания Льюиса) с акцептором электронов (кислота Льюиса) происходят парные взаимодействия между всеми орбиталями донора и акцептора, которые подходят друг другу по симметрии, но все же главный вклад в общую энергию возмущения вносит взаимодействие между граничными орбиталями (разд. 2.3.6) ВЗМО донора (основания) и НСМО акцептора (кислоты). Поэтому при качественном описании любого кислотно-основного взаимодействия достаточно ограничиться рассмотрением лишь взаимных возмущений ВЗМО донора и НСМО акцептора. Если сравниваются две пары: кислота-основание, и энергия электростатического взаимодействия для каждой пары одинакова, то определяющей силу кислотно-основного взаимодействия будет энергия возмущения граничных орбиталей.
На рис. 3.2 схематически представлены четыре возможных случая в зависимости от взаимного расположения по высоте (энергии) НСМО кислоты и ВЗМО основания. Выводы из этих схем справедливы как для заряженных, так и для незаряженных оснований Льюиса, поскольку взаимодействия граничных орбиталей существуют независимо от того, есть общий заряд или нет. Из рисунка видно, что благодаря взаимодействию граничных орбиталей наибольшая стабилизация комплекса АВ получается для кислоты с относительно низкой энергией НСМО и основания с относительно высокой энергией ВЗМО (взаимодействие "мягкий-мягкий"). В этом случае НСМО (А) и ВЗМО (В) близки по энергии, т.е. энергия возмущения имеет большую величину. К кислотам с низкой энергией НСМО относятся ионы тяжелых металлов с пустой s-орбиталью (Cu+, Ag+, Hg2+) или нейтральные молекулы (Br2, I2, тетрацианоэтилен (CN)2C=C(CN)2), а к основаниям с высокой энергией ВЗМО - CN-, RS-, R3P, оксид углерода (СО) и т.д. (т.е. мягкие реагенты по табл. 3.1).
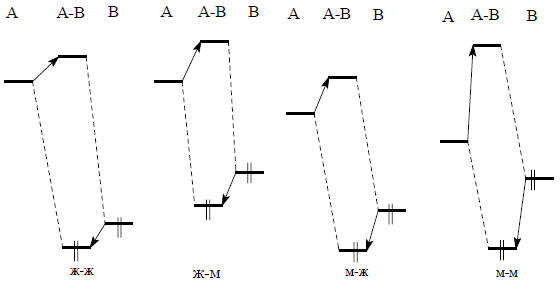
Рис. 3.2. Четыре возможных случая взаимодействия граничных орбиталей при кислотно-основной нейтрализации (НСМО кислоты А, ВЗМО основания В)
Левая диаграмма на рис. 3.2 соответствует типу взаимодействия "жесткий-жесткий". Здесь энергетическое различие между НСМО (А) и ВЗМО (В) настолько велико, что возмущение при взаимодействии этих орбиталей получается очень слабым. Орбитальное взаимодействие не может обеспечить достаточную стабилизацию комплекса АВ, и если этот комплекс не распадается, то только из-за того, что А и В удерживаются вместе электростатическим притяжением (см. ниже).
Поскольку большинство ионов и молекул (за исключением Н+, Не2+, Li3+ и т.п.) имеют и ВЗМО, и НСМО (или соответствующие им атомные орбитали в случае одноатомных частиц), в принципе, любое вещество амфотерно. Чтобы определить, какое из данных соединений будет кислотой, а какое основанием, нужно оценить относительную энергию ВЗМО и НСМО для обоих соединений, помня при этом, что наиболее эффективно с образованием связи, близкой к ковалентной, реагируют орбитали, близкие друг у другу по энергии. Для иллюстрации относительности терминов "кислотность" и "основность" рассмотрим ВЗМО и НСМО трех гипотетических молекул А, В и С в произвольной шкале энергий (см. рис. 3.1). ВЗМО (В) значительно ближе к НСМО (С), чем к НСМО (В) к ВЗМО (С), следовательно, более вероятно, что В поведет себя как основание по отношению к С, а С - как кислота по отношению к В. С другой стороны, энергетическое различие между ВЗМО (А) и НСМО (С) меньше, чем между ВЗМО (С) и НСМО (А), и таким образом, С по отношению к А является основанием. Когда разность энергий между ВЗМО одной молекулы и НСМО второй молекулы примерно равна разности энергий НСМО первой молекулы и ВЗМО второй молекулы, возникает новое явление, которое называется "двусторонним (обратным) связыванием". В этом случае образуются очень прочные аддукты, но нельзя точно сказать, какая из образующих их молекул является кислотой, а какая основанием Двустороннее (обратное) связывание очень распространено в комплексах переходных металлов с органическими молекулами (гл. 27) и играет большую роль в перициклических процессах (гл. 25).
Смотрите также
Свойства вулканизаторов
Механические свойства
резин из фторкаучуков существенно зависят от состава смеси и метода
вулканизации. Например резины полученные радиационной вулканизацией,
превосходят перекисные по теплостойкос ...
Исследование паровоздушной газификации низкосортных углей Украины
В
общей части дипломной работы был проведен литературный анализ методов газификации
угля, выбор о обоснование принципиальной технологической схемы получения
генераторного газа методом пар ...
Химический анализ электролита ванн хлорирования на машиностроительном заводе
...


