Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Теоретическое обоснование принципа ЖМКООрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Теоретическое обоснование принципа ЖМКО Теоретическое обоснование принципа ЖМКОСтраница 1
Первоначально принцип ЖМКО рассматривался как сугубо качественный подход, основанный лишь на рациональном объяснении ряда "повседневных наблюдений". Пирсон в своих статьях убеждал не использовать термин "теория", а рассматривать концепцию ЖМКО лишь как "полезный для химии качественный принцип". Тем не менее теоретики всегда пытались придать этому принципу больше физического смысла, и поставить его хотя бы на полуколичественную основу. Благодаря этому принцип ЖМКО в настоящее время можно описать количественно.
Для количественного описания взаимодействия между кислотой и основанием Льюиса вводятся понятия абсолютной жесткости и абсолютной электроотрицательности молекул. Смысл этих понятий пояснен на рис. 3.1. Абсолютная жесткость (G) - это величина энергетический щели между граничными МО молекул:
G=-[ε(ВЗМО)-ε(НСМО)]/2.
Абсолютная электроотрицательность молекулы (χ) характеризуется положением средней точки между уровнями НСМО и ВЗМО:
χ= -[ε(ВЗМО)+ε(НСМО)]/2.
Чем больше величина G, тем молекула "жестче". Чем больше величина χ, тем молекула более электроотрицательна.
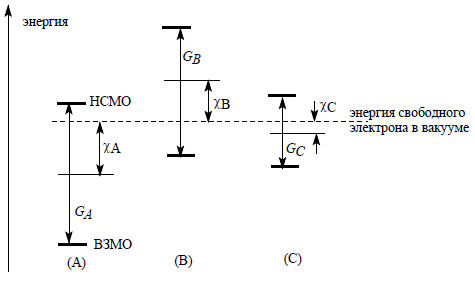
Рис. 3.1. Абсолютная жесткость и абсолютная электроотрицательность молекул. Молекула С мягче молекул А и В. Молекулы А и В имеют одинаковую жесткость, но электроотрицательность молекулы А больше, чем электроотрицательность молекулы В.
При взаимодействии кислоты А с основанием В происходит образование донорно-акцепторного комплекса АВ (реакция (3.2)). Можно полагать, что прочность комплекса АВ, т.е. сила кислотно-основного взаимодействия, будет определяться степенью переноса заряда от В к А. Степень переноса заряда (ΔN ) имеет размерность долей электрона и связана с абсолютной жесткостью и абсолютной электроотрицательностью следующим соотношением:
ΔN=(χA-χB)/GA+GB). (3.3).
Это соотношение показывание, что величина ΔN будет тем больше, чем больше разность электроотрицательностей между молекулами кислоты и основания, и тем меньше, чем больше жесткость взаимодействующих молекул кислоты и основания.
По смыслу разность электроотрицательностей представляет собой термодинамическую движущую силу переноса заряда от основания к кислоте, а сумма абсолютных жесткостей является мерой сопротивления молекул А и В переносу заряда, т.е. связана с их поляризуемостью.
В общем, образование аддукта между кислотой и основанием Льюиса зависит от трех факторов:
1) орбитального взаимодействия, которое можно в первом приближении свести к взаимодействию граничных орбиталей;
2) кулоновского взаимодействия, особенно сильного, когда реагенты имеют противоположные заряды;
3) пространственных препятствий.
При проведении реакций в растворе существует и четвертый фактор, который обобщенно называется сольватацией.
Орбитальное и кулоновское взаимодействия описываются выражением (3.3), поскольку величина G связана с энергией граничных МО, а величина χ - с зарядом молекулы (чем больше положительный заряд, тем молекула более электроотрицательна).
Влияние сольватации будет кратко рассмотрено в этом разделе ниже. Пока же мы более подробно остановимся на первых двух факторах: взаимодействии граничных орбиталей и кулоновском притяжении, и будет считать, что пространственные факторы и сольватация несущественны.
Смотрите также
Алюминий
АЛЮМИНИЙ (лат. Aluminium; от "alumen" —
квасцы), Al, химический элемент III группы периодической системы, атомный номер
13, атомная масса 26,98154.
...
Химические свойства ароматических углеводородов. Полиядерные ароматические соединения
Реакции электрофильного замещения:
галогенирование, нитрование, сульфирование, алкилирование, ацилирование.
Механизм реакции электрофильного замещения. Понятие о p- и s-комплексах, их строен ...


