Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Дисперсионный анализ.Статьи и работы по химии / Дисперсные системы / Статьи и работы по химии / Дисперсные системы / Дисперсионный анализ. Дисперсионный анализ.Страница 3
Адсорбцией называют изменение концентрации вещества на границе раздела фаз. Адсорбция происходит на любых межфазовых поверхностях, и адсорбироваться могут любые вещества. Адсорбционное равновесие, т. е. равновесное распределение вещества между пограничным слоем н граничащими (разами, является динамическим равновесием и быстро устанавливается. Адсорбция уменьшается с. повышением температуры. В ряде случаев поглощение одного вещества другим не ограничивается поверхностным слоем, а происходит во всем объеме сорбента. Такое поглощение называют абсорбцией. Примером процесса абсорбции является растворение газов в жидкостях. Поглощение одного вещества другим, сопровождающееся химическими реакциями, называют хемосорбцией. Так, поглощение аммиака или хлористого водорода водой, поглощение влаги и кислорода металлами с образованием оксидов и гидроксидов, поглощение диоксида углерода оксидом кальция—примеры хемосорб-ционных процессов. Капиллярная конденсация состоит в сжижении паров в микропористых сорбентах. Она происходит вследствие того, что давление паров над вогнутым мениском жидкости в смачиваемых ею узких капиллярах меньше, чем давление насыщенного пара над плоской поверхностью жидкости при той же температуре.
Таким образом, сорбционные процессы различны по их механизму. Однако любой сорбционный процесс начинается с адсорбции на границе соприкасающихся фаз, которые могут быть жидкими, газообразными или твердыми.
Как указывалось в § 106, все самопроизвольные процессы на границах раздела фаз происходят в направлении уменьшения свободной поверхностной энергии. Следовательно, положительная адсорбция, приводящая к повышению концентрации вещества в пограничном слое, возможна только в том случае, если при этом уменьшается величина поверхностного натяжения.
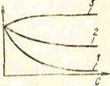
Рассмотрим взаимосвязь поверхностного натяжения растворов с адсорбцией на границе раздела жидкость) газ. Поверхностное натяжение растворов зависит от природы растворителя и растворенного вещества, от концентрации последнего и от температуры. Зависимость поверхностного натяжения растворов при постоянной температуре от концентрации растворенного вещества называют изотермой поверхностного натяжения. Растворенные вещества или понижают поверхностное натяжение растворителя, и в таком случае их называют поверхностно-активными веществами (ПАВ), или повышают поверхностное натяжение (поверхностно - инактивные вещества), или не влияют на величину поверхностного натяжения растворителя (рис. 95). В водных растворах поверхностно-активны полярные органические соединения (спирты, кислоты, амнпы, фенолы). Поверхностно-инактивно большинство сильных электролитов.
|
|
Поверхностно-активные вещества делятся на две большие подгруппы: 1) истинно растворимые в воде и 2) мицеллярные кол-
1'iic. (15. И|"|г|)мы поверхностною натяжения растворов (о — по-tirp\ii»c'iiiuc ингижские, С—концентрация p*iciuopa):
1.2— pilc'riwpbi iiuiH'lwuicTHO-iiKTiiiiiiiiix игщестп (ПАВ) с йгль" mcil (/I и меньше!) (^1 iiuiie|)xnui"rnuil иктипиостыи; я — ра«» tiiii|) иичгрхиогтпи iniiiKTiiuiiuru iieiiwriia.
рис. Ю. Изотерма поверхностного избытка (Г) в растворах поверхностно-активного вещества.
Структура поверхностного слоя: о — вистый растворитель; б — ненасыщенный мономолекулярный слой ПАВ; в — Насыщенный мономолекулярный слой ПАВ
лоиды. ПАВ первой под- д группы представляют собой дифильные молекулы с короткими углеводородными
радикалами, а ПАВ второй подгруппы — дифильные молекулы с длинным углеводородным радикалом, малорастворимые в воде.
Разность концентраций растворенного вещества в поверхностном слое и в таком же слое внутри объема раствора называют поверхностным избытком этого вещества и обозначают греческой буквой Г («гамма»). ПАВ положительно адсорбируются в поверхностном слое и, следовательно, для них Г > 0, поскольку это приводит к уменьшению поверхностного натяжения. Напротив, по-верхностно-инактивные вещества адсорбируются отрицательно, т. е. их концентрация в поверхностном слое меньше, чем в объеме раствора (Г-<0). При этом поверхностное натяжение несколько возрастает в результате того, что в растворах сильных электролитов поверхностные молекулы веды втягиваются внутрь раствора С большей силой, чем в чистой воде.
Смотрите также
Физико-химические методы определения фенола
Аналитическая химия – наука о методах определения химического состава
вещества и его структуры. Однако это определение КС представляется
исчерпывающим. Предметом аналитической химии являются ...
Экспериментальная часть
Измерения
проводили по трехэлектродной схеме: рабочий электрод – стеклоуглеродный
стержень (Æ 0,7 мм), вспомогательный электрод – стеклоуглеродный тигель (V = 25 см3) и электрод сравнения – хл ...
Разработка методов и средств реабилитации объектов отравляющих веществ
Обеспечение безопасности людей и защита окружающей среды (ОС)
являются основополагающими требованиями Конвенции о запрещении разработки,
производства, накопления и применения химического ору ...