Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Редкоземельные металлы и их полуторные оксидыДипломы, курсовые и прочее / Дипломы, курсовые и прочее / Редкоземельные металлы и их полуторные оксиды Редкоземельные металлы и их полуторные оксидыСтраница 13
Относительная устойчивость оксидов в метастабильной С-форме, т.е. оксидов элементов с ионным радиусом, большим, чем у тербия, повышается в ряду от La203 до Gd203. Как видно из рис. 8, одновременно с уменьшением ионного радиуса катиона наблюдается увеличение энергии решетки, а следовательно, и энергии связи М. . .0 [40] (как для устойчивых форм, так и для метастабильной С-формы), что приводит к возрастанию энергии активации и температуры перехода С-формы в устойчивые А- или В-формы.
Кроме этого, уже было показано, что не существует строго определенной температуры фазового перехода, а наблюдается расширенный интервал температур, внутри которого происходит превращение. Так как энергия активации зависит от совершенства кристаллической решетки метастабильной фазы, ширина температурного интервала и его положение сильно зависят от предыстории образца и от дефектности его структуры.
Для обратимых фазовых превращений классическая теория требует наличия определенной температуры перехода кубической модификации в моноклинную. При этой температуре свободная энергия моноклинной фазы GM равна свободной энергии кубической фазы Gk; температура перехода, полученная при нагревании вещества, равна температуре перехода при охлаждении (рис. 6, а).
Однако, как было показано Убберхольдом [41], свободная энергия является функцией не только давления и температуры, но и параметров α и β, характеризующих энергию внутренних напряжений фазы и ее поверхностную энергию, зависящую от состояния соседней фазы. Эти параметры α и β определяются физическим состоянием фаз в системе и существенно различны для зарождающегося зародыша новой фазы и окружающей его матрицы старой фазы.
Таким образом, для оксидов тербия, диспрозия и гольмия вблизи температуры превращения мы имеем четыре функции свободной энергии.
Превращение при нагревании
1) Gk=fk(p, Т, αk, β k)—свободная энергия кубической матрицы,
2) GM’ = fM(p, Т, α'М, β' М)— свободная энергия зародыша кубической фазы в кубической матрице.
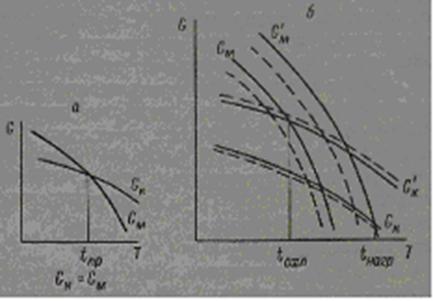
Рис.6. Изменение свободной энергии кубической и моноклинной форм оксидов в зависимости от температуры
а — превращение без гистерезиса; б — превращение с гистерезисом. Пунктиром показано смещение температур фазовых превращений при образовании твердых растворов.
Превращение при охлаждении
3) GМ=fM(p, Т, αM, β M)—свободная энергия моноклинной
матрицы,
4) Gk’ = fk(p, Т, α'k, β' k)—свободная энергия зародыша кубической фазы в моноклинной матрице.
Изменение этих четырех функций Gk, G'M, GM и G’k представлено на рис. 9, б. Условием равновесия будет G'M= Gk при нагревании и G’k = GM при охлаждении. Эта простая схема дает ясное представление о наблюдаемом у этих оксидов явлении гистерезиса: для Tb2О3 Δ(tнагр—tохл)=3000 и для Dy2O3 Δ(tнагр—tохл)=2000 [21]. Кроме этого, для обратимых превращений можно предположить наличие смещении кривых (показано на рис. 6, б пунктиром) свободной энергии в зависимости от совершенства кристаллической решетки каждой из фаз. Однако при высоких температурах и больших скоростях обратимых превращений этот фактор будет оказывать значительно меньшое влияние, чем в случае медленно протекающих необратимых фазовых превращений.
Для однотипных кристаллических веществ термодинамическое условие минимума свободной энергии во многих случаях с достаточной точностью можно заменить условием минимума объема. Критерием объемных изменений, происходящих при образовании соединений, может служить коэффициент компактности структуры q, который равен отношению объема частиц, образующих кристалл, ко всему объему кристалла:
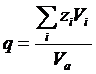
где zi — число частиц сорта i в элементарной ячейке, Vi — объем частицы, Va — объем элементарной ячейки. Из рисунка видно, что коэффициент q изменяется симбатно с изменением — ΔН0 (исключение составляют только оксиды европия и иттербия, склонные к восстановлению при высоких температурах). А-тип структуры является наиболее устойчивым для оксидов элементов с ионным радиусом, большим чем 0.97 А, т. е. для La2О3, Ce2О3, Рr2О3, Nd2О3. Для элементов с меньшим ионным радиусом более устойчивым является В-тип структуры. С-тип структуры является наименее плотно упакованным. Поэтому возможно осуществить С → В-превращение воздействием высокого давления [23]. Однако В-формы оксидов от Но2О3 до Lu2О3 устойчивы только при высоком давлении и переходят обратно в С-формы при снижении давления.
Смотрите также
Введение
Колебательные процессы играют существенную роль в
жизнедеятельности различных организмов, определяя основной механизм многих
явлений биологической подвижности (летательные мышцы насекомых, биение се ...
Йод
ИОД (лат. Iodium), I - химический элемент VII
группы периодической
системы Менделеева, относится к галогенам (в литературе
встречается также символ J); атомный номер 53, атомная масса 126, ...
Выводы
Методом линейной
циклической вольтамперометрии исследовано совместное восстановление ионов
гадолиния и алюминия в хлоридных и хлоридно-фторидных расплавах на серебряном и
платиновом электродах.
...


