Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кислотно-основные свойства
химических соединенийОткрытая химия / Растворы / Открытая химия / Растворы / Кислотно-основные свойства
химических соединений Кислотно-основные свойства
химических соединенийСтраница 4
Рассуждая аналогичным образом, можно вывести уравнения для раствора слабого основания и его соли (NH3∙H2O и NH4Cl):
| |
или
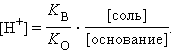 |
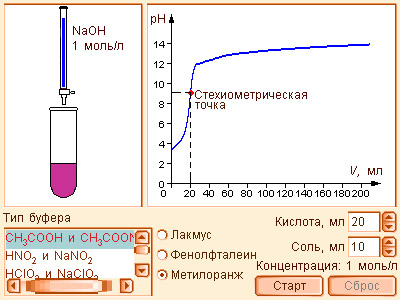
Из предыдущих уравнений видно, что концентрация ионов водорода при разбавлении сохраняется, ибо отношения [кислота] : [соль], [соль] : [основание] остаются постоянными. Добавление к такой смеси кислоты или щелочи приводит к связыванию избыточных ионов H+ анионами, а OH– – катионами. Это смещает равновесие диссоциации слабого электролита, в результате чего концентрация H+ практически не меняется. Растворы, содержащие смесь слабого электролита и его соли, сохраняющие характерные для него значения pH при разбавлении, добавлении сильных кислот или щелочей, называются буферными.
|
|
|
Модель 6.8. Титрование |
Если к одному литру ацетатного буфера, содержащего по 0,1 моля уксусной кислоты (K = 1,86 · 10–5) и ее соли, имеющего [H+] = 1,86 ∙ 10–5, pH 4,73, добавить 10 мл HCl (0,01 моля), то в результате реакции
| |
концентрация кислоты увеличится, а соли уменьшится на 0,01 моля; тогда
| |
Добавление такого же количества щелочи приведет к увеличению [CH3COO–]:
| |
Тогда
|
Смотрите также
Разработка процесса производства изопропилбензола на ОАО "Омский каучук"
...
Происхождение и состав нефти
...
Место реакции Белоусова-Жаботинского в химии и современной науке
Автоколебательная
реакция Белоусова-Жаботинского очень широко известна не только в научном мире.
Ее знают как школьники и студенты, так и просто любознательные люди. Стакан с
красно-лиловой ...