Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кислотно-основные свойства
химических соединенийОткрытая химия / Растворы / Открытая химия / Растворы / Кислотно-основные свойства
химических соединений Кислотно-основные свойства
химических соединенийСтраница 3
В пределах одной группы элементов сила кислоты уменьшается по мере увеличения радиуса кислотообразующего элемента:
| |
Для многоосновных кислот способность к депротонизации уменьшается по мере увеличения отрицательного заряда аниона:
| |
При этом константа диссоциации каждой последующей ступени уменьшается примерно на пять порядков:
|
K1 : K2 : K3 = 1 : 10–5 : 10–10. |
На состояние динамического равновесия, в котором находится раствор слабого электролита, сильно влияет присутствие одноименного иона. Так, диссоциация уксусной кислоты протекает по схеме
| |
и для этой реакции
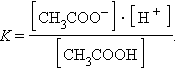 |
Прибавление к раствору уксусной кислоты ее соли (CH3COONa → CH3COO– + Na+) резко увеличивает концентрацию ионов CH3COO– и смещает равновесие в сторону образования недиссоциированных молекул кислоты. Ее диссоциация теперь пренебрежимо мала, и концентрация недиссоциированных молекул почти равна концентрации кислоты, тогда при [CH3COOH] = [кислота], и [CH3COO–] = [соль] концентрация H+ равна
| |
или
|
Следовательно, концентрация ионов H+ этого раствора будет определяться соотношением концентраций кислоты и соли, взятых для его приготовления.
Смотрите также
Кинетика химических реакций.
Цель работы - изучение
скорости химической реакции и ее зависимости от различных факторов: природы
реагирующих веществ, концентрации, температуры.
Учение о
скорости химической реакции называетс ...
Синтез сорбента нековалентно-модифицированного арсеназо I. Сорбционное извлечения Cu (II) из хлоридных растворов
В последнее время все большее значение в аналитической
практике приобретают сорбционные методы концентрирования ионов металлов. Это
обусловлено их высокой чувствительностью, селективностью и ...
Металлы побочной подгруппы I группы
Мета́лл
(название происходит от лат. metallum — шахта) — группа элементов, обладающая
характерными металлическими свойствами, такими как высокая тепло- и
электропроводность, положитель ...


