Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Димер HF. Геометрическая
конфигурация, колебания, энергия связиУчим химию / Водородные связи / Учим химию / Водородные связи / Димер HF. Геометрическая
конфигурация, колебания, энергия связи Димер HF. Геометрическая
конфигурация, колебания, энергия связиСтраница 1
На рисунке 1.2 изображена равновесная геометрическая конфигурация комплекса, одновременно и понятная и непредсказуемая. Все четыре атома располагаются в одной плоскости. Расстояния между атомами фтора и водорода, относящиеся к составным (мономерным) частям комплекса Fb–Hb и Ff–Hf , равны соответственно 0,922 и 0,920 Å и мало отличаются от равновесного расстояния 0,917 Å в молекуле HF. Расстояние между атомами Hb…Ff равно 1,82 Å, что характерно для водородной связи. Расположение всех трех участников водородной связи Fb–Hb…Ff близко к линейному. Это все предсказуемые черты межмолекулярного комплекса с водородной связью. Непредсказуемыми из простых принципов оказываются значения углов θ1 = 7 ̊ (между направлениями FbFf и FfHb) и θ2 = 69 ̊ (FbFf и FfHf).
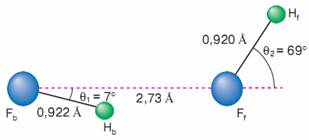
Рисунок 1.2 Равновесная геометрическая конфигурация комплекса (HF)2 [7]
Рассмотрим, как были получены эти результаты. Олигомеры фторида водорода (HF)n образуются в распространяющейся со сверхзвуковой скоростью струе газа, истекающей из узкого сопла контейнера с веществом HF, находящегося при низких температурах. Контроль состава газа осуществляют масс-спектральными методами [8], что позволяет различить компоненты газа по массе, то есть различить олигомеры с разными значениями n. Подбором условий можно добиться того, чтобы исследованию подвергались именно димерные комплексы (HF)2.
В камере спектрометра молекулярный пучок подвергается действию электромагнитного излучения от источника определенного интервала длин волн (или частот) и фиксируется спектр исследуемой системы. Спектральные линии в микроволновом диапазоне, как сказано выше, несут информацию о вращении молекулы, и относительное расположение полос зависит от геометрической конфигурации системы. Интерпретация полос в диапазоне 19 300-19 340 МГц в рамках модели полужесткого волчка позволила установить соответствие спектра структуре, показанной на рис. 1, с расстоянием между атомами фтора Fb-Ff 2,72 ? 0,03 Б и углами q1 = 10 ? 6? и q2 = 63 ? 6?. Близкие значения углов были независимо получены и в другой лаборатории: q1 = 7 ? 3? и q2 = 60 ? 2?.
В следующих сериях экспериментов исследовали инфракрасный (ИК) диапазон спектра. Согласно основным моделям теории строения молекул, расположение спектральных линий в этой области несет информацию о колебаниях частиц молекулы около положения равновесия, в данном случае о небольших периодических смещениях атомов от позиций, показанных на рис. 1. Для каждой молекулы число таких колебаний однозначно определяется числом атомов и для комплекса (HF)2 оно равно шести. В молекулярной спектроскопии принято выражать частоты колебаний в единицах, показывающих число полных волн данной длины, укладывающихся на расстоянии в 1 см, и соответственно говорят о величинах частот, выраженных в обратных сантиметрах (см-1), или, что то же самое, в волновых числах. Хотя в каждом колебании с данной частотой принимают участие в той или иной мере все атомы молекулы, опять-таки в рамках модельных представлений можно отнести колебание (и соответственно полосу в ИК-спектре) к выделенной группе атомов. Во многих случаях такому подразделению способствуют значительные различия в частотах колебаний, как в нашем примере (HF)2 .
Оцененные по измерениям спектральных полос в газовой фазе и инертных матрицах частоты колебаний димера фторида водорода явно разделяются на внутримолекулярные (имеются в виду колебания молекул, при ассоциации которых образовался комплекс) с величинами около 4000 см-1 и межмолекулярные с величинами менее 500 см-1. Высокие частоты относятся к колебаниям групп Ff-Hf (3931 см-1) и Fb-Hb (3868 см-1). Низкие частоты (475, 395, 161 и 125 см-1) характеризуют колебания, меняющие относительную ориентацию фрагментов Ff-Hf и Fb-Hb , выход атомов из плоскости и изменения расстояния Fb_Ff .
Интенсивность ИК-линий можно связать (снова в рамках определенной модели молекулы) с такой важнейшей характеристикой комплекса, как энергия диссоциации на две мономерные молекулы. Эта же величина определяет энергию связи комплекса. По экспериментальным данным, она составляет 19,35 ? 0,71 кДж/моль. Таким образом, расшифровка спектров приводит к набору молекулярных постоянных - расстояниям между атомами, углам, частотам колебаний, энергиям, которые достаточно полно характеризуют строение молекулярной системы.
Обратимся теперь к теоретическому подходу. Все построения основаны на модели, согласно которой комплекс (HF)2 есть система четырех ядер (двух протонов и двух ядер F9 +) и 20 электронов, то есть точечных частиц, попарно взаимодействующих по закону Кулона. Больше никакой исходной информации в модель не закладывается, что и делает такие расчеты свойств молекул столь привлекательными. Для этой конкретной системы четырех ядер и 20 электронов методами вычислительной квантовой химии рассчитывают поверхность потенциальной энергии - зависимость энергии от координат ядер [2]. Конечно, необходим доступ к компьютерам и достаточно сложному программному обеспечению, однако сейчас для такой системы, как (HF)2 , очень хорошие результаты можно получать с персональным компьютером типа "Pentium" за вполне реальное время, хотя требуются терпение и определенные навыки.
Смотрите также
Применение каучуков
Фторкаучуки – каучуки
специального назначения, применяемые в производстве изделий и деталей, в
которых должны сочетаться высокая стойкость к действию агрессивных сред и
теплостойкость. Фторкаучуки ...
Определение содержания аскорбиновой кислоты в яблоках различных сортов
Большинство зимних сортов яблок отличается невысокой
С-Р витаминностью, и на них можно не останавливаться. Количество витамина С к
весне обычно составляет у яблок половину бывшего к потреби ...


