Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
ФерментыУчим химию / Учим химию / Ферменты ФерментыСтраница 3
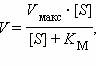
где V – скорость реакции, [S] – концентрация субстрата, Vмакс – максимальная скорость реакции, достигаемая при бесконечной концентрации субстрата, Kм – константа Михаелиса.
Скорость ферментативной реакции может быть замедлена специальными веществами – ингибиторами. Некоторые ингибиторы ферментов – смертельные яды для человека, тогда как другие являются ценными лекарствами. К таким лекарствам относятся, например, сульфаниламидные препараты. Многим видам болезнетворных бактерий для роста необходима пара-аминобензойная кислота H2N–C6H4–COOH. Они используют ее для синтеза более сложного соединения – фолиевой кислоты, важного витамина. Сульфаниламид H2N–C6H4–SO3H (бытовое название – стрептоцид) и его производные похожи на пара-аминобензойную кислоту, они связываются с ферментом, участвующим в синтезе фолиевой кислоты, занимая субстрат-связывающий участок активного центра. Но они не могут вступить в реакцию, которую катализирует фермент, а просто сидят в активном центре и не дают вступить в реакцию истинному субстрату – пара-аминобензойной кислоте. В результате бактерия не может синтезировать необходимый ей витамин. Человек не имеет этого фермента, он должен получать фолиевую кислоту с пищей, поэтому для человека сульфаниламидные препараты безвредны (однако они угнетают полезную микрофлору кишечника, так что принимать их следует только по назначению врача).
Сульфаниламид как бы конкурирует с пара-аминобензойной кислотой за активный центр фермента, поэтому такие ингибиторы получили название конкурентных. В присутствии конкурентных ингибиторов Vмакс не меняется – ведь при очень большой концентрации субстрат "победит" в конкуренции с ингибитором. Другой класс ингибиторов – неконкурентные – связываются не с активным центром фермента, а с другим его участком. Они не влияют на связывание субстрата, но уменьшают максимальную скорость, изменяя конформацию молекулы фермента. И конкурентные, и неконкурентные ингибиторы связываются с ферментом обратимо.
Существует еще один класс ингибиторов – необратимые. Они ковалентно связываются с молекулой фермента. Так, антибиотик пенициллин необратимо связывается с микробным ферментом гликопептид-транспептидазой, синтезирующим муреин (см. урок 3), и нарушает синтез клеточной стенки. Целый ряд мощных нервно-паралитических боевых отравляющих веществ (зарин, зоман, V-газы) необратимо ингибируют фермент ацетилхолин-эстеразу, необходимый для расслабления скелетных мышц. В результате отравления этими веществами дыхание становится невозможным из-за спазма дыхательных мышц, и наступает смерть – смертельная доза для человека вещества VX составляет всего 0,0004 г.
В клетке активность многих ферментов регулируется. Одним из наиболее распространенных механизмов регуляции активности ферментов является аллостерическая регуляция. У ферментов, регулируемых таким способом, кроме активного центра имеется еще один очень важный участок – аллостерический центр. Он обратимо связывает специальные регуляторы, обычно это небольшие молекулы массой менее 1 килодальтона. После связывания регулятора конформация всей белковой глобулы изменяется, и фермент изменяет эффективность своей работы.
Одни аллостерические регуляторы ингибируют активность фермента, тогда как другие активируют ее. Некоторые ферменты имеют несколько аллостерических центров.
Аллостерическая регуляция часто используется в обмене веществ для ингибирования конечным продуктом. Представьте себе, что в организме синтезируется некоторое вещество Z, концентрацию которого необходимо поддерживать на постоянном уровне. Это вещество синтезируется из предшественника А в несколько стадий:
Смотрите также
Расчет тарельчатой ректификационной колонны для разделения бинарной углеводородной смеси бензол-толуол
Ректификация
известна с начала девятнадцатого века, как один из важнейших технологических
процессов главным образом спиртовой и нефтяной промышленности. В настоящее время
ректификацию всё ш ...
Вред курения
Арабская
пословица гласит: « Кури, и тебя не укусит собака, потому что ты плохо пахнешь.
Кури - и тебя не ограбят, потому что ты испугаешь грабителей кашлем. Кури, и
тебе не грозит старость ...
Химический анализ электролита ванн хлорирования на машиностроительном заводе
...


