Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Форма канонических молекулярных орбиталейОрганическая химия / Атомные и молекулярные орбитали / Органическая химия / Атомные и молекулярные орбитали / Форма канонических молекулярных орбиталей Форма канонических молекулярных орбиталейСтраница 4
В фотоэлектронных спектрах первый потенциал ионизации этилена соответствует удалению электрона с π-орбитали. Если восстанавливать этилен, например, щелочными металлами, то молекула принимает электрон на π*СС-орбиталь (см. рис. 1.19), которая является самой низкой из незанятых МО, и поэтому дополнительный электрон на ней имеет самую низкую энергию. Следовательно, π и π*-орбитали в этилене имеют особое значение: электрон удаляется в первую очередь с π-орбитали, а принимается на π*-орбиталь. Аналогично можно утверждать, что в реакции с электрофильными агентами (например, протоном) участвует высшая занятая π-МО (ВЗМО), а в реакции с нуклеофильными агентами (например, с анионами) участвует нижняя свободная π*-МО (НСМО). ВЗМО и НСМО играют главную роль в химии алкенов, поэтому их выделяют среди других МО. Они называются граничными орбиталями, а метод, основанный на использовании относительной плотности граничных орбиталей для предсказания реакционной способности органических молекул называется методом граничных орбиталей. Этот метод впервые был предложен лауреатом Нобелевской предмии по химии 1981 г. К.Фукуи. В настоящее время он широко применяется для оценки кислотности и основности органических соединений, описания реакций замещения типа SN2, реакций Дильса-Альдер, 1,3-диполярного циклоприсоединения, электроциклических реакций, ароматического электрофильного замещения и т.д. Применение этого метода будет рассмотрено в соответствующих разделах.
форма орбиталей

симметрия энергия обозначение
(эскиз) (ккал/моль) МО
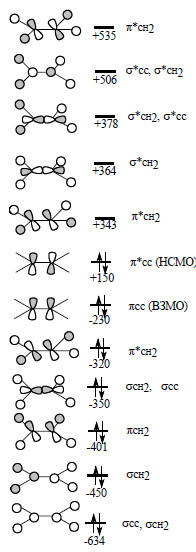
Рис. 1.19. МО молекулы этилена.
Для соединений с тройной связью, простейшим представлителем которых является ацетилен (этин) НС≡СН, имеется пара вырожденных ВЗМО и пара вырожденных НСМО, соответствующие двум ортогональным π-свзям (рис. 1.20). ВЗМО ацетилена имеет более низкую энергию (-260 ккал/моль), чем ВЗМО этилена (-230 ккал/ моль), поэтому следует ожидать, что с электрофильными агентами тройная связь будет реагировать хуже, чем двойная. Экспериментально это доказано для большинства электрофилов, хотя имеются и исключения.
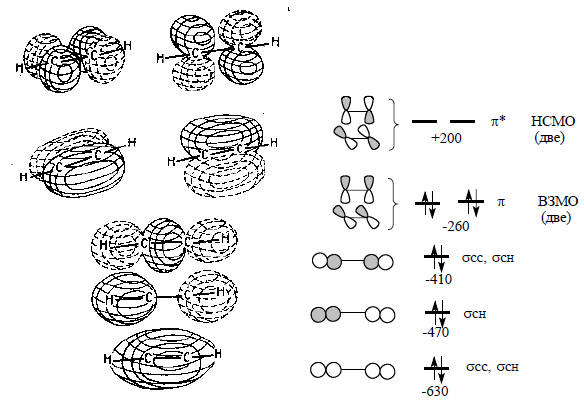
Рис. 1.20. МО молекулы ацетилена. Три высшие разрыхляющие орбитали не показаны.
π-Орбитали могут охватывать не только два атома углерода, как в молекуле этилена или ацетилена, но также три, четыре или большее число атомов. Простейшим примером является аллильная система (аллильный катион, аллильный радикал или аллильный анион), в которой π-орбитали распространяются на три атома углерода (рис. 1.12). В катионе занята лишь низшая орбиталь ψ1, и она является ВЗМО. Следующая орбиталь ψ2 в радикале занята одним, а в анионе - двумя электронами. Эта орбиталь несвязывающая; она имеет нулевой вклад от р-орбитали центрального атома углерода С2, через который проходит вертикальная зеркальная плоскость симметрии. Орбиталь ψ2 в аллильном анионе является ВЗМО. В случае радикала верхняя, занятая одним электроном молекулярная орбиталь сокращенно обозначается как ОЗМО (однократно занятая молекулярная орбиталь). Высшая орбиталь ψ3 в основном электронном состоянии катиона, аниона и радикала не занята.
Смотрите также
Анализ индивидуального риска событий узла пиролиза этановой фракции
...
Ненаркотические анальгетики
...
Жидкостно-жидкостная хроматография
Хроматография - это
физико-химический метод разделения и анализа смесей газов, паров, жидкостей или
растворенных веществ сорбционными методами в динамических условиях.
Метод основан на ра ...


