Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Форма канонических молекулярных орбиталейОрганическая химия / Атомные и молекулярные орбитали / Органическая химия / Атомные и молекулярные орбитали / Форма канонических молекулярных орбиталей Форма канонических молекулярных орбиталейСтраница 1
Гибридные орбитали хорошо соответствуют представлениям классической теории химической связи, согласно которой связь осуществляется парой электронов, локализованных между ядрами двух атомов, образующих связь.
В рамках классической структурной теории ковалентная связь характеризуется строго определенным направлением в пространстве. С другой стороны, квантово-механические расчеты приводят к каноническим орбиталям, для которых характерна высокая степень делокализованности: они не принадлежат отдельным связям, а охватывают сразу все ядра или большие группы в данной молекуле.
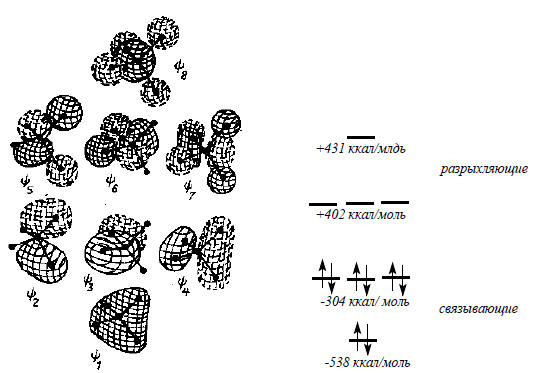
Рис. 1.14. Форма канонических МО молекулы СН4. Сплошные и пунктирные линии отражают разные знаки волновой функции. Приведены вычисленные значения энергии орбиталей. Знак «минус» означает выигрыш энергии при заселении орбитали электроном, а знак «плюс» - проигрыш энергии.
Метан. На рис. 1.14 приведены контурные диаграммы восьми МО молекулы метана: четыре связывающих (ψ1-ψ4) и четыре разрыхляющих (ψ5-ψ8). Эти орбитали напоминают «надувные шарики».
Они получены путем так называемого неэмпирического квантовохимического расчета. Нижняя, «самая связывающая» орбиталь ψ1 охватывает все пять атомов. Хотя на рис. 1.14 показано тетраэдрическое расположение связей, форма орбитали ψ1 вовсе не говорит об этом. Ясно лишь то, что все пять ядер расположены внутри ψ1, но вопрос о том, как они расположены, даже не ставится. Выше орбитали ψ1 располагаются три вырожденные заполненные орбитали ψ2, ψ3, ψ4. Каждая из этих орбиталей имеет по одной узловой плоскости, проходящей через атом углерода. Орбиталь ψ2 имеет горизонтальную узловую плоскость, перпендикулярную плоскости чертежа; на ней кроме атома углерода лежат также два атома водорода (левые на чертеже). Орбиталь ψ3 имеет вертикальную узловую плоскость, расположенную в плоскости чертежа; в ней также лежат два атома водорода (правые). Таким образом, орбитали ψ2 и ψ3 характеризуюются нулевой амплитудой орбитали сразу на трех ядрах: С и двух Н, которые расположены в узловой плоскости. Орбиталь ψ4 имеет вертикальную узловую плоскость, перпендикулярную плоскости чертежа; она проходит через центральный атом углерода.
Еще выше по энергии располагаются три вырожденные МО метана ψ5, ψ6, ψ7. Как видно из рис. 1.14, число узловых плоскостей для этих орбиталей больше, чем для ψ2, ψ3, ψ4, т.е. соблюдается правило: больше узлов - выше энергия. На самой разрыхляющей является орбиталь ψ8, имеющая узлы между каждой парой атомов углерода и водорода СН4. Только из эскиза этой орбитали следует тетраэдрическое строение метана (ср. с ψ1), так как узловые поверхности ориентированы перпендикулярно направлениям к углам тетраэдра. Таким образом, форма молекулы наиболее ясно выявляется при рассмотрении формы самой разрыхляющей МО.
Существование двух и только двух различающихся по энергии занятых уровней в молекуле метана, нижний из которых соответствует орбитали ψ1, а второй, более высокий, - орбиталям ψ2, ψ3, ψ4, имеет четкое экспериментальное доказательство, состоящее в том, что у молекулы метана есть два потенциала ионизации. Потенциалы ионизации обычно находят из фотоэлектронных спектров, представляющих собой орбитальный энергетический спектр данной молекулы. Фотоэлектронные спектры дают информацию о том, какая энергия необходима для удаления электрона с определенной орбитали. Наличие в фотоэлектронном спектре двух пиков, соответствующих потенциалам ионизации около 13 и 23 эВ*, показывает, что картина, изображенная на рис. 1.14, верна, т.е. восемь валентных электронов расположены на двух разных энергетических уровнях: потенциал 13 эВ соответствует орбиталям ψ2, ψ3, ψ4, а потенциал 23 эВ - орбитали ψ1. Если же молекулу метана описывать с помощью гибридных орбиталей, то мы придем к выводу, что у СН4 должен быть лишь один потенциал ионизации, так как все четыре СН-связи, образованные sp3- гибридными орбиталями углерода и 1s-орбиталями водорода, должны быть равноценными.
Смотрите также
Мышьяк
Мышьяк (As)
Мышьяк (лат.
Arsenicum), As, химический элемент V группы периодической системы Менделеева, порядковый
номер 33, атомная масса 74,9216; кристаллы серо-стального цвета. Элемент
...
О растворах
...


