Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Форма канонических молекулярных орбиталейОрганическая химия / Атомные и молекулярные орбитали / Органическая химия / Атомные и молекулярные орбитали / Форма канонических молекулярных орбиталей Форма канонических молекулярных орбиталейСтраница 3
Отметим еще две особенности молекулы HF. Во-первых орбитальψ1 образуется перекрыванием в фазе орбиталей H1s и F2s, самая верхняя орбиталь образуется из H1s и F2р в противофазе), но не является антисвязывающей комбинацией H1s и F2s. Это связано со следующими причинами. Как уже отмечалось выше, связи H-F образуется путем взаимодействия не только H1s и F2s, но и H1s и F2p. Оно приводит к гибридизации, которая была рассмотрена в разделе 1.8.1 на примере молекулы LiH. Поскольку фтор - самый электроотрицательный атом (табл. 1.1.), его энергетические уровни, т.е. уровни АО, лежат значительно ниже соответствующих уровней атома водорода. Самые близкие по энергии - уровни H1s и F2р, поэтому они взаимодействуют наиболее сильно. В результате их взаимодействия в фазе и противофазе образуются соответственно орбитали ψ2 и ψ3. Орбиталь же F2s взаимодействует с H1s слабо, и в первом приближении можно считать, что она практически сохраняет свою форму. Именно поэтому орбиталь ψ1 очень похожа на 2s-орбиталь атома фтора (рис. 1.16). Более детально этот вопрос разбирается в главе 2.
Молекулы с неподеленными парами: Н2О и NH3. В молекуле воды (рис. 1.17) из шести МО занято четыре, а две верхние свободны. В отличие от HF, в Н2О нет вырожденных уровней. Высшая занятая МО является несвязывающей и локализована на атоме кислорода, это одна из «неподеленных пар». Следующая, более низкая занятая МО является настолько слабо связывающей, что ее можно ассоциировать со второй неподеленной парой. Видно, что кислород обладает большей электронной плотностью, чем атомы водорода.
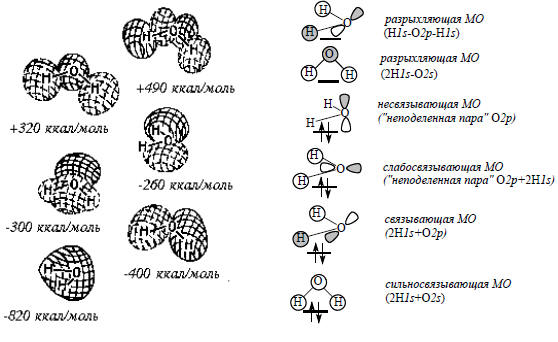
Рис. 1.17. МО молекулы Н2О
В молекуле NH3 (рис. 1.18) имеются две вырожденыые связывающие МО. Высшая занятая МО - очень слабо связывающая; она имеет одну долю, направленную от атомов водорода, и поэтому соответствует неподеленной паре.
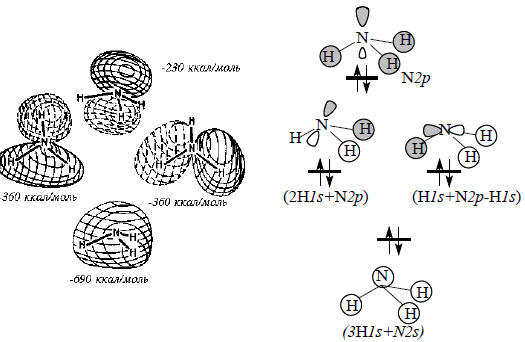
Рис. 1.18. МО молекулы NH3.
В молекулах HF, H2O, NH3 высшими занятыми молекулярными орбиталями (ВЗМО) являются орбиталя π-типа, несущие неподеленные электронные пары. Сравнение энергий этих орбиталей (рис. 1.16-1.18) позволяет расположить молекулы в следующий ряд: NH3 (-230) > H2O (-260) > HF (-410 ккал/моль). Таким образом, самая высокая энергия ВЗМО у молекулы NH3, и, следовательно, можно ожидать что неподеленная пара молекулы аммиака должна наиболее легко вступать в химические реакции. Это согласуется с высокой основностью и нуклеофильностью аммиака и органических аминов.
Молекулы с π-связями. Простейшей органической молекулой такого типа является молекула этилена СН2=СН2. При рассмотрении молекул с неподеленными парами мы видели, что несвязывающие орбитали, несущие неподеленные пары (ВЗМО) занимают самые высокие уровни энергии по сравнению со связывающими орбиталями σ-типа. По аналогии можно предположить, что в молекуле этилена самый высший из заполненных уровней будет соответствовать связывающей орбитали π-связи. Как видно из рис. 1.19, это действительно так.
Смотрите также
Алюминий и основные его соединения
...
Разработка дополнительных занятий в школе к теме "Химизм различных способов приготовления пищи"
Проблема пищи всегда
была одной из самых важных проблем, стоящих перед человеческим обществом.
Все, кроме кислорода,
человек получает для своей жизнедеятельности из пищи. Среднее потребле ...
Пластические массы и синтетические смолы
Пластические массы и синтетические
смолы исключительно
важны практически для всех отраслей народного хозяйства. В настоящее время
ускорение научно-технического прогресса в области науки и т ...


