Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
МолибденБиблиотека / Библиотека / Молибден МолибденСтраница 6
![]()
![]()
В аналитической практике часто приходится встречаться с гидролизом солей. Гидролиз может способствовать выполнению реакции, а иногда мешает проведению анализа. Имеются следующие способы подавления и усиления гидролиза солей.
1. Прибавление к раствору соли другого электролита, кислоты или основания.
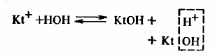
Для усиления гидролиза солей (в т.ч. ![]() ) добавляют основания для связывания в процессе гидролиза ионов H+:
) добавляют основания для связывания в процессе гидролиза ионов H+:
![]()
Равновесие реакции смещается в сторону гидролиза соли.
Для подавления гидролиза указанных солей к раствору добавляют кислоты, тогда:
![]()
![]()
В такой ситуации увеличивается количество ионов H+ и реакция смещается в обратную сторону, т.е. уменьшается гидролиз соли.
Для изменения гидролиза можно прибавлять и другие ионы электролитов: HCO3-, HPO42-, HSO4-. Для связывания OH- ионов используют их способность образовывать комплексные ионы: [Co(OH)]+, [Al(OH)]2+, [Al(OH)2]+ и др.
9. Окислительно-восстановительные реакции.
9.1. Дайте оценку восстановительных свойств Мо и окислительно-восстановительных свойств его ионов в зависимости от его рН среды (используйте справочные характеристики).
Мерой окислительно-восстановительной способности веществ служат их окислительно-восстановительные (электродные) потенциалы (φ0). Чем больше алгебраическая величина стандартного окислительно-восстановительного потенциала данного атома или иона, тем больше его окислительные свойства, а чем меньше алгебраическое значение окислительно-восстановительного потенциала атома или иона, тем больше его восстановительные свойства.
9.2. Составьте уравнения 3-х окислительно-восстановительных реакций ( с использованием вещества содержащего ионы данного металла) при рН>7, рН=7, рН<7. 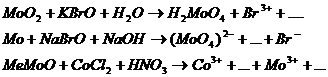
Предварительно рассчитайте Е0 химической реакции, используя метод электронно-ионного баланса.
10. Электрохимические свойства металла.
10.1. Прогнозируйте отношение данного металла в компактном виде к атмосфере сухого воздуха (при комнатной температуре и нагревании), к влаге (без аэрации и при аэрации), к неокислительным и окислительным кислотам (на холоду и при нагревании), к растворам и расплавам щелочей.
Литой и плотно спеченный молибден при комнатной и слегка повышенной температуре стоек против действия воздуха и кислорода. При нагревании до темно-красного каления поверхность металла быстро тускнеет и около 600°С молибден загорается, выделяя белый дым – возгон МоО3. Налет окисла легко разрушается и при длительном нагревании происходит полное сгорание металла до МоО3. Молибденовый порошок окисляется при еще более низкой температуре, а наиболее мелкий порошок способен самовозгораться на воздухе. При нагревании во влажной атмосфере, в среде восстановительного или инертного газа, не очищенных тщательно от кислорода и паров воды, наблюдается постепенное более или менее полное окисление металла по реакции:
![]()
При нагревании молибдена в токе SO2 образуется смесь окислов и дисульфида молибдена, в токе НС1 – летучие хлориды (МоСІ3) и оксихлориды молибдена.
В растворах, содержащих окислитель (кислород, HNO3, НС1О3 и др.), молибден окисляется. Растворы при недостатке окислителя окрашиваются в синий цвет. Азотная кислота, одна и в смеси с соляной и серной – окисляет и растворяет металл:
![]()
При избытке кислоты из бесцветного раствора выпадает белый или слегка желтоватый осадок молибденовой кислоты Н2МоО4. Концентрированная HNO3 задерживает растворение, создавая пассивирующую пленку окислов. Разбавленная НС1 довольно хорошо растворяет компактный металл: за 18 ч потеря массы 20-30%. В концентрированной НС1 растворение более медленное: за 18 ч при 110°С потеря массы 0,34%:
![]()
Фтористый водород и плавиковая кислота быстро действуют на молибден, переводя его во фториды. Разбавленная H2SO4 (d=l,3 г/мл) слабо действует на молибден даже при 110°. Концентрированная H2SO4 (d= 1,82 г/мл) на холоду действует слабо: за 18 ч потеря массы 0,24%. При 200 – 250°С растворение идет быстрее. Фосфорная и органические кислоты воздействуют на металл слабо, но в присутствии окислителей (в том числе воздуха) растворимость заметно увеличивается.
Смотрите также
Диаграммы состояния трехкомпонентных систем
...
Анализ почв и агрохимический анализ
...
Химия в быту
В моем реферате
пойдет речь о химических веществах, применяемых в быту и облегчающих домашний
труд, ведь бытовая химия - это не только стирка, уборка, но и покраска, очистка помещений, отдел ...


