Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Координационная, водородная и металлическая связи.Статьи и работы по химии / Атомно-молекулярное учение и его законы / Химическая связь и строение молекул. / Статьи и работы по химии / Атомно-молекулярное учение и его законы / Химическая связь и строение молекул. / Координационная, водородная и металлическая связи. Координационная, водородная и металлическая связи.Страница 2
Водородная связь.
Название этого типа химической связи показывает, что в её образовании принимает участие атом водорода. Этот тип связи очень распространён и играет значительную роль во многих химических процессах.
Возникновение водородной связи можно объяснить действием электростатических сил. В молекуле воды между атомами водорода и кислорода существует полярная ковалентная связь. При её образовании электронное облако, принадлежащее атому водорода, сильно смещается к атому кислорода, который характеризуется высокой электроотрицательностью. В результате этого атом кислорода приобретает отрицательный заряд, а ядро водорода (протон) почти полностью лишается электронного облака. Между протоном и отрицательно заряженным атомом кислорода соседней молекулы воды возникает электростатическое притяжение. Протон, обладающий ничтожно малыми размерами, способен проникать в электронные оболочки других атомов, что и приводит к образованию водородной связи. В результате проявления водородной связи происходит ассоциация молекул воды и связывание их в димеры, тримеры, тетрамеры и т. д.
Водородная связь образуется и во фтороводороде: HF---HF, где донором электронов является атом фтора. Процесс образования водородной связи при взаимодействии двух молекул HF можно представить следующей схемой:
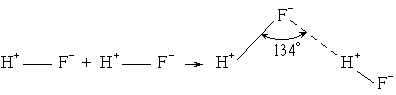
Таким образом, возникновения водородной связи следует ожидать в тех случаях, когда атом водорода в молекуле соединения непосредственно связан с атомом элемента, обладающего высокой электроотрицательностью. Чаще всего водородная связь проявляется в соединениях фтора, кислорода и в меньшей мере в соединениях азота.
Для оценки прочности связей между атомами лользуются понятием энергия связи. Энергия связи ¾ это работа, необходимая для разрыва этой связи во всех молекулах, составляющих один моль вещества. Это одна из важнейших характеристик химической связи, измеряют её в килоджоулях на моль (кДж/моль). Энергия связи между двумя данными атомами зависит от её кратности, которая определяется числом электронных пар, связывающих эти атомы. С увеличением кратности связи возрастает и энергия связи. Например, энергия одинарной связи C–C в молекуле этана равна 263 кДж/моль, двойной связи C=C в этилене составляет 422 кДж/моль, тройной связи CºC в молекуле ацетилена равна 535 кДж/моль. Важной характеристикой связи является также её длина, которая измеряется расстоянием между ядрами связанных атомов. При увеличении кратности связи её длина уменьшается: C–C 0,154 нм; C=C 0,134 нм; CºC 0,120 нм.
Энергия водородной связи значительно меньше энергии ковалентной связи и в среднем составляет 10–40 кДж/моль (энергия ковалентной связи кислорода с водородом равна 460 кДж/моль, энергия связи атомов в молекуле азота ¾ 920 кДж/моль). Однако энергии водородной связи достаточно, чтобы вызвать ассоциацию молекул. Вследствие ассоциации, затрудняющей отрыв молекул друг от друга, такие вещества, как фтороводород, вода, аммиак, имеют более высокие, чем можно было ожидать, температуры плавления и кипения. Водородная связь обусловливает некоторые важные особенности воды, а также таких веществ, как белки и нуклеиновые кислоты.
Смотрите также
Обмен углеводов
Биосинтетические процессы,
протекающие в клетках, нуждаются не только в энергии, им необходимы также
восстановительные эквиваленты в виде НАДФН+Н + и целый ряд
моносахаридов, имеющих в свое ...
Введение
С давних лет человечество мечтает о лекарстве,
которое при действии на организм обладало бы максимальной избирательностью,
благодаря чему эффективно устраняется причина болезни, но не возникают
неж ...
Фермент
Одним из фундаментальных понятий, как
биологии,так и химии является понятие “фермент”.Изучение ферментов имеет
большое значение для любой области биологии,а также для многих отраслей
химич ...


