Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Координационная, водородная и металлическая связи.Статьи и работы по химии / Атомно-молекулярное учение и его законы / Химическая связь и строение молекул. / Статьи и работы по химии / Атомно-молекулярное учение и его законы / Химическая связь и строение молекул. / Координационная, водородная и металлическая связи. Координационная, водородная и металлическая связи.Страница 1
Координационная связь.
Выше показано, что полярная и неполярная ковалентные связи образуются общей парой электронов, представленной двумя атомами, между которыми возникает химическая связь. Например, атом азота, имеющий в стационарном состоянии электронную структуру внешнего слоя 2s22p3, за счёт трёх неспаренных p-электронов образует три ковалентные связи с атомами водорода, превращаясь в аммиак. Два спаренных s-электрона атома азота в этой реакции участия не принимают, эта электронная пара остается неподелённой. Если точками обозначить электроны, первоначально принадлежавшие атому азота, а крестиками ¾ принадлежавшие атомам водорода, то электронную структуру молекулы аммиака можно представить следующей схемой:
![]()
Из восьми электронов внешнего электронного слоя атома азота шесть принимают участие в образовании трёх ковалентных связей и являются общими для атома азота и атомов водорода, а два принадлежат только атому азота. Эта электронная пара может принимать участие в образовании ковалентной связи с другим атомом, имеющим свободную электронную орбиталь.
Например, у атома водорода на 1s-орбитали находится один электрон, а у иона водорода эта орбиталь свободна. Поэтому между молекулой аммиака и ионом водорода возникает ковалентная связь, в которой неподеленная электронная пара атома азота становится общей для двух атомов. Образование иона аммония можно представить схемой:
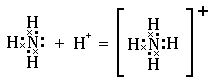
Другой пример. Атом бора с конфигурацией внешнего электронного слоя 2s22p1 в трифториде бора приобретает электронную структуру 2s22p4. Следовательно, атом бора в этом соединении имеет одну вакантную p-орбиталь и может принять на неё электронную пару. Действительно, трифторид бора способен соединяться с молекулой аммиака:
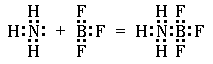
Из приведенных схем видно, что в образовании химической связи участвует неподелённая пара электронов, ранее принадлежавшая только атому азота. При образовании химической связи эта пара электронов становится общей для обоих атомов, дополняя до восьми количество электронов во внешнем электронном слое. Атом (или ион), представляющий свою неподелённую пару при образовании химической связи, называется донором. Атом (или ион), принимающий на свободную орбиталь эту неподеленную электронную пару, называется акцептором. Ковалентную связь, возникающую между двумя атомами за счет неподелённой электронной пары одного из них, называют донорно-акцепторной или координационной связью. В рассмотренных примерах донором электронной пары служит атом азота, а акцепторами ¾ ион водорода и атом бора.
Экспериментально доказано, что в ионе NH4+ все четыре связи азота с водородом равноценны, хотя три из них возникли по механизму образования ковалентной связи, а одна ¾ донорно-акцепторная. Следовательно, ковалентная и координационная связи тождественны по свуей природе и различаются лишь способом образования.
Координационная связь осуществляется при образовании координационных соединений. В таких соединениях может проявляться одновременно несколько типов химической связи. Так, в координационном соединении [Cu(NH3)4]SO4 между комплексным катионом [Cu(NH3)4]2+ и ионом сульфата SO42- осуществляется ионная связь. Между ионом меди Cu2+ и четырьмя молекулами аммиака NH3 существует донорно-акцепторная связь. Наконец, между атомами азота и водорода в аммиаке, а также между атомами серы и кислорода в ионе сульфата возникает полярная ковалентная связь.
Смотрите также
Иод
53
I
7 18 18 8 2
ИОД
126,904
5s25p5
...
Формально–кинетический анализ гипотез
...
Амины жирного ряда (алифатические амины)
Изомерия в ряду алифатических аминов связана с изомерией
углеводородного радикала и количеством заместителей у атома азота.
Многие амины имеют тривиальные названия. По рациональной
номенклатуре н ...


