Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
МылаДипломы, курсовые и прочее / Органическая химия / Дипломы, курсовые и прочее / Органическая химия / Мыла МылаСтраница 1
МЫЛА, соли высших жирных кислот с числом углеродных атомов от 12 до 18, обладающие поверхностно-активными свойствами. Различают мыла растворимые в воде и нерастворимые. Растворимые мыла содержат катион щелочного металла: натрия, реже калия. Поэтому их называют щелочными мылами. Эти мыла получают щелочным гидролизом жиров, например:
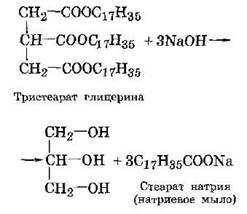
Водорастворимые мыла обладают наиболее сильным моющим действием и получили наибольшее распространение.
Мыла с катионами кальция, магния, алюминия и др. в воде не растворяются; называют их «металлическими» мылами. Эти мыла получают обычно по реакции обмена между щелочными мылами и солями соответствующих металлов. Металлические мыла используют как загустители пластических смазок, ускорители высыхания лакокрасочных материалов и пр.
В промышленности в качестве исходных веществ для получения натриевого щелочного мыла применяют животные жиры (сало низких сортов), растительные масла (хлопковое, пальмовое, кокосовое и др.), гидрогенизированные жиры, а также жирозаменители (например, синтетические жирные кислоты, канифоль). При нагревании сырья с гидроксидом натрия образуется густой раствор - «мыльный клей», содержащий глицерин и соли жирных кислот. При охлаждении раствор затвердевает и превращается в т. наз. клеевое мыло, используемое для хозяйственных и технических нужд (содержание основного вещества - 40-55%).
Мыла получают также, используя высшие углеводороды нефти - парафин. Парафин окисляют до карбоновых кислот (смесь), выделяют из смеси нужные кислоты и действием соды Na2CO3 переводят их в натриевую соль.
Как соли сильных оснований и слабых кислот, мыла в водных растворах подвергаются гидролизу, например:
![]()
поэтому растворы мыла имеют щелочную реакцию.
Мыла обладают особыми поверхностно-активными свойствами, поэтому в растворах они проявляют моющее действие. В жесткой воде моющее действие мыла слабое. Это обусловлено взаимодействием их с ионами кальция, приводящим к образованию малорастворимых солей:
В кислой среде мыла разлагаются с образованием высших карбоновых кислот.
Мыла применяются не только как моющие средства. Они являются компонентами смазок, реагентами для флотации.
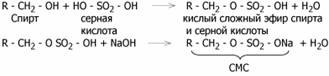
Мыла плохо моют в жесткой воде. Поэтому развивается производство синтетических моющих средств (СМС). СМС – соли кислых сложных эфиров высших спиртов и серной кислоты:
Жёсткость воды обычно определяют титрованием щелочным раствором комплексного соединения трилона Б. По количественному содержанию ионов Са2+ и Mg2+ природную воду различают как очень мягкую (концентрация этих ионов до 30 мг/л), мягкую (30-80 мг/л), средней жёсткости (80-150 мг/л), жёсткую (150-250 мг/л) и очень жёсткую (свыше 250 мг/л). Особенно большой жёсткостью отличается вода морей и океанов. В океанах средняя концентрация в воде ионов кальция 450 мг/л, магния -1290 мг/л и общая - 1740 мг/л. Напротив, многие воды северных рек и рек, имеющих ледниковое питание, очень мягки. Вода для хозяйственных нужд и для питья - водопроводная вода - имеет концентрацию ионов Са и Mg не более 170 мг/л.
В жёсткой воде растворённые в ней соли при нагревании и испарении воды образуют в паровых котлах, отопительных приборах и на стенках металлической посуды слой накипи, который плохо проводит теплоту. Для удаления накипи приходится применять специальные вещества - антинакипины- гл. обр. органические кислоты, например адипиновую НООС(СН2)4СООН и щавелевую НООССООН, растворяющие накипь.
Смотрите также
Обозначения.
Vп
Мольный
объем паровой фазы
Vж
Мольный
объем жидкой фазы
Sп
Мольная
энтропия паровой фазы
Sж
...
Происхождение ископаемых углей
Практически невозможно установить точную дату,
но десятки тысяч лет назад человек, впервые познакомился с углём, стал
постоянно соприкасаться с ним. Так, археологами найдены доисторические
...
Органические красители
Понятие
«красящее вещество» подразумевает возможность окрашивания любого субстрата. #
хранения волокон, подкрашивание пищевых продуктов (пищевые пасты, сливочное
масло и т.д.) все окрашенны ...


