Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Задачи с решениямиДипломы, курсовые и прочее / Кинетика химических и электрохимических процессов / Сложные реакции / Дипломы, курсовые и прочее / Кинетика химических и электрохимических процессов / Сложные реакции / Задачи с решениями Задачи с решениямиСтраница 1
1.
Для обратимой реакции первого порядка 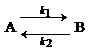
Кр = 8, а k1 = 0,4 c-1. Вычислите время, при котором концентрации веществ А и В станут равными, если начальная концентрация вещества В равна 0.
Решение. Из константы равновесия находим константу скорости обратной реакции: k-1 = k1/К = 0,4/8 = 0,05 с-1. По условию мы должны найти время, за которое прореагирует ровно половина вещества А. Для этого надо подставить значение х(t) = а/2 в решение кинетического уравнения для обратимых реакций:
t![]() .
.
Ответ: t = 1,84 с.
2.
В параллельных реакциях первого порядка С ¬ А ® В выход вещества В равен 63%, а время превращения а на 1/3 равно 7 мин. Найдите k1 и k2.
Решение. Кинетическое уравнение для разложения вещества в параллельных реакциях имеет вид уравнения первого порядка![]() , в которое вместо одной константы входит сумма констант скорости отдельных стадий. Следовательно, по аналогии с реакциями первого порядка, по времени превращения А на 1/3 (х(t) = a/3) можно определить сумму констант k1 + k2:
, в которое вместо одной константы входит сумма констант скорости отдельных стадий. Следовательно, по аналогии с реакциями первого порядка, по времени превращения А на 1/3 (х(t) = a/3) можно определить сумму констант k1 + k2:
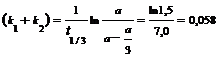 мин-1.
мин-1.
Выход вещества В равен 63%, а вещества D – 37%. Отношение этих выходов равно отношению конечных концентраций веществ В и D, следовательно оно равно отношению соответствующих констант скоростей
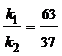 . Решая это уравнение совместно с предыдущим, находим: k1 = 0,037, k2 = 0,021.
. Решая это уравнение совместно с предыдущим, находим: k1 = 0,037, k2 = 0,021.
Ответ: k1 = 0,037 мин-1, k2 = 0,021 мин-1.
3.
В системе протекают две параллельные реакции А + 2В→ → продукты (k1) и A +2C → продукты (k2). Отношение k1/ k2 = 5. Начальные концентрации веществ В и С одинаковы. К моменту времени t прореагировало 50% вещества В. Какая часть вещества С прореагировала к этому моменту?
Решение. Запишем кинетические уравнения для первой и второй реакций: ![]() . Поделив одно кинетическое уравнение на другое, избавимся от временной зависимости и получим дифференциальное уравнение, описывающее фазовый портрет системы, т. е. зависимость концентрации одного из веществ от концентрации другого:
. Поделив одно кинетическое уравнение на другое, избавимся от временной зависимости и получим дифференциальное уравнение, описывающее фазовый портрет системы, т. е. зависимость концентрации одного из веществ от концентрации другого: ![]() с начальным условием [В]0 = [С]0. Это уравнение решается методом разделения переменных:
с начальным условием [В]0 = [С]0. Это уравнение решается методом разделения переменных: ![]() , где константа находится из начального условия
, где константа находится из начального условия ![]() . Подставляя в это решение [В] = [В]0/2, находим [С] = 5[В]/6 = 5[С]0/6, т.е. к моменту времени t прореагирует 1/6 вещества С.
. Подставляя в это решение [В] = [В]0/2, находим [С] = 5[В]/6 = 5[С]0/6, т.е. к моменту времени t прореагирует 1/6 вещества С.
4.
Реакция разложения изопропилового спирта протекает в присутствии катализатора триоксида ванадия при 588 К с образованием ацетона, пропилена и пропана. Концентрации веществ реакции, измеренные через 4,3 с после начала опыта, следующие, ммоль: с![]() ; с
; с![]() ; с
; с![]() . Определите константу скорости каждой реакции, если в начальный момент в системе присутствовал только С3Н7ОН.
. Определите константу скорости каждой реакции, если в начальный момент в системе присутствовал только С3Н7ОН.
Решение: Определим начальное количество С3Н7ОН: [А]0 = с1 + с2 + с3 + с4 = 24,7 + 7,5 + 8,1 + 1,7 = 44,7 ммоль/л. Вычислим сумму констант скоростей реакций:
![]()
![]()
![]() ,
, ![]() c-1.
c-1.
Смотрите также
Полимеризующиеся и специальные поверхностно-активные вещества
...
Деформируемые алюминиевые сплавы
Металловедение – наука,. Изучающая строение
и свойства металлов и устанавливающая связь между их составом, строением и
свойствами.
В данном реферате приведены общие и
теоретические сведе ...


