Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Необходимые исходные сведения и основные уравненияДипломы, курсовые и прочее / Кинетика химических и электрохимических процессов / Электродвижущие силы. электродные потенциалы / Дипломы, курсовые и прочее / Кинетика химических и электрохимических процессов / Электродвижущие силы. электродные потенциалы / Необходимые исходные сведения и основные уравнения Необходимые исходные сведения и основные уравненияСтраница 2
в) хлорсеребряный электрод Cl-│AgCl, Ag, на котором идет электродная реакция AgCl + e = Ag+ + Cl-;
φ![]() φ
φ![]() .
.
Окислительно-восстановительные электроды (редокси – электроды) представляют собой инертный металл, опущенный в раствор, содержащий окисленную и восстановленную формы. Уравнение Нернста для данных электродов имеет вид:
φ Red = φ![]() , (2.9)
, (2.9)
где аОх(аО) ― активность окисленного иона; aRed(aВ) - активность восстановленного иона. Они делятся:
а) на простые: Fe3+ + e = Fe2+; n = 1; aRed = ![]() ; aOx =
; aOx = ![]() ;
;
φ = φ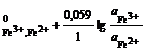 ; (2.10)
; (2.10)
![]() ; n = 1;
; n = 1; ![]() ;
; ![]() ;
;
φ = φ![]() ; (2.11)
; (2.11)
б) на сложные:
![]() ;
;
φ = φ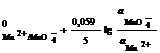 . (2.12)
. (2.12)
Хингидронный электрод: C6H4O2 (хинон) + 2H+ + 2e = = C6H4(OH)2 (гидрохинон);
n = 2, aRed = aгх = 1; аОх = ах = 1;
φ = φ![]() + φ
+ φ![]() . (2.13)
. (2.13)
Связь константы равновесия химической реакции и стандартных электродных потенциалов выражается соотноше-нием
![]() (φ02 – φ01).n/0,0592 (Т = 298 К). (2.14)
(φ02 – φ01).n/0,0592 (Т = 298 К). (2.14)
Для концентрационных цепей уравнение Нернста (при отсутствии диффузионного потенциала) для электродов типа
Cu | Cu2+ ║ Cu2+ | Cu ; Ag, AgCl | HCl ║ HCl | Ag, AgCl
a1 a2 (a2 > a1) a1 a2 (a2 > a1)
имеет вид
![]() , (2.15)
, (2.15)
где а1 и а2 ─ активности ионов Cu2+ и Cl- соответственно.
Для электродов 2-го рода типа: Pt, H2 (P1) | HCl | Pt, H2 (P2), уравнение (2.15) преобразуется в уравнение
![]() (Р1/Р2), (2.16)
(Р1/Р2), (2.16)
где P1 и P2 - давления водорода, P1 > P2.
Для амальгамного элемента: Hg [Cd] (a1) | Cd2+ | Hg [Cd] (a2), (a2 > a1), уравнение Нернста имеет вид
![]() (а1/а2), (2.17)
(а1/а2), (2.17)
где a1 и a2 ─ активности металлического кадмия в амальгаме. Для элемента типа: Cd(ж) (a1 = 1) | Cd в расплаве солей | Cd в расплаве Cd – Sn (a2) уравнение (2.17) принимает вид
![]() , (2.18)
, (2.18)
где a2 ─ активность кадмия в расплаве Cd – Sn.
Расчет ЭДС концентрационной цепи (например, серебряной, Ag | AgNO3 (а1) ║ AgNO3 (а2) | Ag,) производится по формуле
Е = 2. 0,059. l∞,![]() . lg(а1/а2) /(l∞,
. lg(а1/а2) /(l∞,![]() +l∞,
+l∞,![]() ) (2.19)
) (2.19)
Смотрите также
Cложные эфиры
...
Типы реакций и их классификация в органической химии
...
Характеристика абсорбционных методов очистки отходящих газов от примесей кислого характера
Грандиозные
масштабы производственной деятельности человека привели к большим позитивным
преобразованиям в мире – созданию мощного промышленного и сельскохозяйственного
потенциала, широкому ...


