Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Необходимые исходные сведения и основные уравненияДипломы, курсовые и прочее / Кинетика химических и электрохимических процессов / Электродвижущие силы. электродные потенциалы / Дипломы, курсовые и прочее / Кинетика химических и электрохимических процессов / Электродвижущие силы. электродные потенциалы / Необходимые исходные сведения и основные уравнения Необходимые исходные сведения и основные уравненияСтраница 1
ЭДС гальванического элемента Е равна разности условных электродных потенциалов его полуэлементов φ1 и φ2. Если значением диффузионного потенциала можно пренебречь то
Е = φ2 - φ1(2.1)
(индекс 2 относится к более положительному электродному потенциалу). Электрохимические реакции, протекающие на электродах, и сами электроды разделяют на следующие типы:
1. Электроды 1-го рода, обратимые по катиону: Меn+ + ne = = Ме0, где Меn+ и Ме0 ― окисленная и восстановленная формы вещества; nе - количество электронов. Потенциал электрода 1-го рода рассчитывается по уравнению Нернста:
φ = φ0![]() (aOx/aRed),(2.2)
(aOx/aRed),(2.2)
где φ - потенциал электрода, В; φ0 - стандартный потенциал электрода, В; n - число электронов, участвующих в элемен-тарной реакции; F - число Фарадея; aRed и aOx - активности вос-становленной и окисленной форм вещества, вступающего в реакцию. Множитель ![]() при Т = 298 К и значении R, равном 8,31 Дж/(моль.К), равен 0,059. К электродам 1-го рода относятся:
при Т = 298 К и значении R, равном 8,31 Дж/(моль.К), равен 0,059. К электродам 1-го рода относятся:
а) серебряный электрод:
Ag+│Ag; Ag+ + e = Ag0; n =1;aOx = aAg+; aRed = aAg =1,
φ = φ0Ag+ ![]() lgaAg+; (2.3)
lgaAg+; (2.3)
б) амальгамный электрод:
Cd2+ │[Cd] (Hg)Cd2+ + 2e = [Cd]ам; n = 2; aOx = aCd+
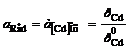 ; φ = φ0AСd2+
; φ = φ0AСd2+ 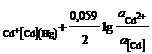 ,(2.4)
,(2.4)
где φ![]() - потенциал амальгамного электрода при активности кадмия в амальгаме, а[Cd] = 1;
- потенциал амальгамного электрода при активности кадмия в амальгаме, а[Cd] = 1;
в) газовый электрод:
H+ │Pt, H2; H+ + e =½ H2; n = 1; aOx = aH++; aRed = ![]() =
= ![]() ;
;
φ = φ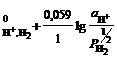 .(2.5)
.(2.5)
2. Электроды 2-го рода, обратимые по аниону, представляют собой металл, покрытый труднорастворимой солью этого метал-ла, который находится в равновесии с раствором, содержащим соответствующий анион: AgCl + e = Ag + Cl-; n=1; aOx = aAgCl = 1; aRed = aCl-;
φ = φ![]() ; (2.6)
; (2.6)
φ02 = φ![]() ,(2.7)
,(2.7)
где j ![]() ― стандартный потенциал серебряного электрода, обратимого по катиону; ПРAgCl ― произведение растворимости хлорида серебра. К электродам 2-го рода относятся:
― стандартный потенциал серебряного электрода, обратимого по катиону; ПРAgCl ― произведение растворимости хлорида серебра. К электродам 2-го рода относятся:
а) газовый электрод:
½ Cl2 + e = Cl-; n = 1; aOx = ![]() ; aRed =
; aRed = ![]() ;
;
φ = φ![]() . (2.8)
. (2.8)
б) каломельный электрод Cl-│Hg2Cl2, на котором идет электродная реакция HgCl2 + 2e = Hg+ + 2Cl- ;
φ![]() φ
φ![]() .
.
Смотрите также
Общие сведения о спиртах. Полиолы
...
Химия в быту
В моем реферате
пойдет речь о химических веществах, применяемых в быту и облегчающих домашний
труд, ведь бытовая химия - это не только стирка, уборка, но и покраска, очистка помещений, отдел ...
Математическое моделирование полимерных синтетических дисперсий медицинского назначения
...


