Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Физико-химические основы коагулирования примесей водыДипломы, курсовые и прочее / Дипломы, курсовые и прочее / Физико-химические основы коагулирования примесей воды Физико-химические основы коагулирования примесей водыСтраница 6
(А1(ОН)3 содержится в твердой фазе и концентрация его в растворе постоянна), откуда [Al3+]=k'[H+]3.
Для второго уравнения константа равновесия:
![]()
Или
![]()
откуда
![]()
седиментация примесь коагуляция гидролиз
где к® — ионное произведение воды (величина постоянная, зависящая только от температуры).
Таким образом, растворимость А1(ОН)3 в кислой среде, прямо пропорциональна концентрации водородных ионов в третьей степени [Н+]3, а в щелочной — обратно пропорциональна [Н+].
Осаждение А1(ОН)3 начинается при рН=3 и становится полным при рН=7. Дальнейшее повышение рН ведет к растворению осадка (пептизации), заметному при рН=9. Рентгенографически установлено, что в гидрокарбонатно-хлоридных и гидрокарбонатно-сульфатных средах частички формируются с образованием гидроаргиллита —А1(ОН)3, способного существовать в этих условиях длительное время.
При коагулировании в кислых и нейтральных средах, содержащих небольшое количество гидрокарбонатов, для нейтрализации ионов Н+, накапливающихся в воде при гидролизе A12(S04)3, можно применять смесь A12(S04)3 и NaA102. В этом случае накапливающиеся ионы Н+ будут нейтрализоваться ионами ОН-, образующимися при гидролизе NaAl02:
![]()
Если в смеси выдержано необходимое соотношение между A12(S04)3 и NaA102, то при гидролизе значение воды практически не изменяется и гидролиз обоих реагентов протекает достаточно полно.
Гидролиз FeCI3 протекает в три стадии:
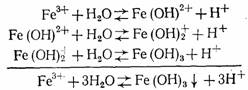
Гидролиз железного купороса в воде выражается уравнением
![]()
Поскольку растворимость Fe(OH)2 велика и он значительно диссоциирован, равновесие гидролиза сильно смещено влево. Образующийся Fe(OH)2 под действием кислорода, растворенного в воде, окисляется в Fe(OH)3:
![]()
Хлопья FeCb наиболее интенсивно образуются при рН=5 . . 7, причем оптимум находится между значениями рН 6,1 и 6,5. Изоэлектрическая точка Fe(OH)3 соответствует значению рН несколько большему, чем 6,5. Хлопьеобразование Fe(OH)3, в отличие от Аl(ОН)3, протекает в значительно более широком диапазоне значений рН. Рентгенографически установлено, что при гидролизе солей железа (III) в гидрокарбонатно-хлоридных и гидрокарбонатно-сульфатных средах образуется одна и та же модификация гидроксида железа(III) — гетитa-FeO(OH). Характерно, что a-гидроксид железа(III) образуется и в случае гидролиза солей железа(II), например, железного купороса, окисляемого хлором или растворенным в воде кислородом при подщелачивании известью.
Для нормальной коагуляции большую роль играют размеры и структура частичек гидроксидов, причем размеры частичек, выделяющихся при гидролизе коагулянтов, зависят главным образом от степени пересыщения раствора. В процессе водоочистки гидролиз солей-коагулянтов протекает в разбавленных растворах, что создает условия слабого пресыщения и благоприятствует образованию крупных частичек при обеспечении необходимого периода времени на их формирование. Структура выделяющихся из раствора частичек зависит от скорости двух протекающих одновременно процессов: беспорядочного слипания частичек при столкновениях (агрегации) и роста кристаллов (ориентации). При незначительном пересыщении главную роль играет скорость ориентации, которая у гидроксидов понижается с увеличением числа гидроксильных ионов, связанных с атомом металла. Поэтому частички гидроксидов двухвалентных металлов имеют кристаллическую форму, а гидроксиды трехвалентных металлов (алюминия и железа) выделяются главным образом в аморфном состоянии.
Смотрите также
Равновесные и поляризационные диаграммы потенциал-pH
В настоящее время
большую важность имеет возможность оценивать устойчивость металлов и их сплавов
к коррозии в тех или иных условиях. Эту возможность позволяет реализовать на
практике приме ...
Медь
29
Cu
1 18 8 2
МЕДЬ
63,546
3d104s1
...
Цинк
30
Zn
2 18 8 2
ЦИНК
65,38
3d104s2
...


