Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Физико-химические основы коагулирования примесей водыДипломы, курсовые и прочее / Дипломы, курсовые и прочее / Физико-химические основы коагулирования примесей воды Физико-химические основы коагулирования примесей водыСтраница 5
Полнота гидролиза имеет большое значение как для самой коагуляции, так и для качества очищаемой воды, поскольку наличие ионов алюминия в очищенной питьевой воде недопустимо.
Скорость гидролиза можно описать уравнением:
![]()
где v — скорость гидролиза; Кг — константа гидролиза; [Мел+] — концентрация катионов в растворе коагулянта; [Н20] — концентрация воды в растворе.
Из уравнения следует, что скорость гидролиза пропорциональна концентрации катионов коагулянта. Поскольку применяющиеся концентрации растворов коагулянта незначительны, можно считать, что скорость гидролиза коагулянта прямо пропорциональна его концентрации (или его дозе), введенной в воду. Согласно правилу Вант—Гоффа с повышением температуры на каждые 10 градусов скорость гидролиза, как и большинства химических реакций, возрастает примерно в 2—4 раза.
Необходимым условием для более полного протекания гидролиза является удаление из сферы реакции образующихся Fe(OH)3 или А1(ОН)3, а также связывание ионов Н+ в малодиссоциированные молекулы. Гидролиз усиливается с разбавлением коагулянта.
Более полному гидролизу подвержены коагулянты, образующие гидроксиды с меньшей константой диссоциации (величиной, характеризующей способность электролитов диссоциировать на ионы) или меньшим произведением растворимости.
Гидролиз солей железа (III) протекает полнее, чем солей алюминия, и значительно полнее, чем солей железа (II).
Как следует из уравнения, с увеличением степени гидролиза рН раствора должно уменьшаться. Любое повышение рН раствора обеспечивает полный гидролиз введенного в воду коагулянта. Для быстрого и полного гидролиза коагулянтов необходим некоторый щелочной резерв воды, т. е. наличие в ней определенного количества ионов НС03-, ОН-, которые связывают ионы водорода, выделяющиеся при гидролизе:
![]()
Благодаря наличию в воде буферной системы НС03-—Н2СО3 с рН, близким к 7, рН воды при гидролизе коагулянтов в большинстве случаев изменяется незначительно (уменьшается).
По уравнению гидролиза коагулянтов можно вычислить концентрацию ионов НС03-, необходимую для нейтрализации кислоты, образующейся при гидролизе определенной дозы коагулянта. Из суммарной реакции гидролиза Al2(S04)3 в присутствии ионов НС03-
Al2 (S04)3 + ЗСа (НС03)2 + 6Н20 = 2А1 (0Н)3 + 3CaS04 + 6Н2СО
следует, что на каждые 342 м г A12(S04)3 расходуется 6 мг-экв НСОз-.
В тех случаях, когда концентрация ионов ОН-, НС03~, содержащихся в воде, недостаточна для полного гидролиза коагулянта, щелочность воды повышают введением известкового молока или раствора соды. В первом случае эффект подщелачивания объясняется связыванием ионов Н+ ионами ОН- извести, во втором — связыванием ионов Н+ в ионы НС03-.
Зная щелочность обрабатываемой воды и дозу введенного коагулянта, можно вычислить дозу извести или соды, необходимой для гидролиза и обеспечения резервной остаточной щелочности, равной 1 мг-экв/л.
Гидролиз солей алюминия, используемых в качестве коагулянтов, протекает в несколько стадий:
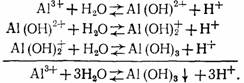
Степень гидролиза повышается с разбавлением раствора, повышением его температуры и рН.
Гидроксид алюминия является типичным амфотерным соединением, т. е. обладает как кислотными, так и основными свойствами:
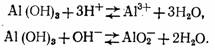
Константа равновесия для первого уравнения
![]()
Смотрите также
Определение фенола методом броматометрического титрования
...
Монослой на поверхности
воды
Наряду с полностью гидрофильными и
гидрофобными молекулами существуют еще и молекулы вроде русалок – одна их часть
гидрофильная, а другая гидрофобная. [7]Такие молекулы получили название амфифильных ...
Фосфор и его соединения
Пятая группа Периодической системы включает два типических элемента азот
и фосфор – и подгруппы мышьяка и ванадия. Между первым и вторым типическими
элементами наблюдается значительное раз ...


