Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Электропроводность в равновесных продуктах детонацииДипломы, курсовые и прочее / Исследование распределения электропроводности в пересжатых детонационных волнах в конденсированных взрывчатых веществах / Дипломы, курсовые и прочее / Исследование распределения электропроводности в пересжатых детонационных волнах в конденсированных взрывчатых веществах / Электропроводность в равновесных продуктах детонации Электропроводность в равновесных продуктах детонацииСтраница 1
Будем считать твёрдо установленным фактом существование в нормальных детонационных волнах двух зон электропроводности [9,10]: зоны высокой электропроводности, связанной с химической реакцией, и низкой - в равновесных продуктах детонации. Поскольку зона высокой электропроводности связана с существенно неравновесной областью в детонационной волне, мы остановимся на электропроводности в равновесных продуктах детонации.
Предполагая электронный механизм проводимости для объяснения экспериментальных результатов необходимо рассмотреть природу возникновения электронов, их концентрацию и длину свободного пробега. Иными словами необходимо объяснить величину s в равновесных продуктах детонации порядка 0,1-1 Ом-1см-1 и её экспоненциальный спад в продуктах детонации тротила.
Продукты детонации являются сложным объектом для исследования, поэтому автор отдает себе отчёт, что приводимое ниже рассмотрение носит оценочный характер.
Концентрация электронов в плотных газах обычно находят с помощью изменённой формулы Саха [19,31,37]. Изменение заключается во введении эффективного потенциала ионизации Ieff
. Значительное взаимодействие молекул продуктов детонации облегчает ионизацию, иными словами уменьшает потенциал ионизации.
Оценим концентрацию атомов и молекул в продуктах детонации и характерные размеры. Для оценок будем считать плотность равновесных продуктов детонации в плоскости Чепмена-Жуге равной ρ0
= 2 г/см3. Число атомов в единице объёма будет равно
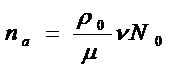 , (5)
, (5)
где μ– молекулярный вес молекул исходного взрывчатого вещества, N
0
– число Авогадро, ν
– число атомов в исходной молекуле. Для всех рассмотренных взрывчатых веществ: тротила, октогена, гексогена, тэна - получаем na
= 1,1·1023 см-3. Среднее расстояние между атомами a
= (na
)-1/3 ≈ 2·10-8 см. Размеры атомов, входящих в молекулы взрывчатых веществ (C
,
O
,
N
,
H
) лежат в пределах (1-1,6)·10-8 см. Совпадение межатомных расстояний с характерными размерами атомов свидетельствуют о том, что энергия взаимодействия атома с атомами в молекуле имеет близкую величину, что и энергия взаимодействия атома с атомами соседних молекул. Именно это взаимодействие и облегчает ионизацию.
Если считать молекулы равновесных продуктов детонации 3х атомными, тогда их число в единице объёма будет nm
= na
/3 = 3,4 ·1022 см-3. Среднее межмолекулярное расстояние am
= (n
m
)-1/3 ≈ 3·10-8 см, совпадает с характерными размерами самих молекул.
Уравнение состояния продуктов детонации для оценок возьмём в виде
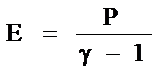 [38], (6)
[38], (6)
где Е
– внутренняя энергия единицы объёма продуктов детонации, P
– давление, γ
– показатель изоэнтропы. По данным [3] при ρ0
= 2 г/см3 давление в плоскости Чепмена-Жуге составляет примерно 300 кбар. Энергия W
, приходящаяся на одну молекулу, будет
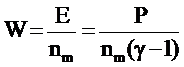 , (7)
, (7)
и при γ= 3 получим W≈ 5 эВ. Поскольку тепловая энергия порядка kT
= 0,3 эВ ( Т
= 3,5 ·105 К ) и кинетическая энергия как целого ρ0
u
2
/2
nm
≈ 0,5 эВ значительно меньше полной энергии молекулы W
следует ожидать, что на близкую величину изменится энергия или потенциал ионизации.
Другая оценка снижения потенциала ионизации [31,37] может быть получена следующим образом. Молекула в условиях плотноупакованных продуктов детонации может считаться ионизованной, если электрон удалился от неё на am
. Тогда снижение потенциала ионизации по абсолютной величине будет равно работе сил электрического поля при переносе электрона от am
на бесконечность. Эта работа будет Δ
I
= e
2
/
am
= 5 эВ. По крайней мере, полученная величина снижения потенциала ионизации свидетельствует о решающей роли плотности продуктов детонации во влиянии на ионизацию, а, следовательно, и на концентрацию электронов (металлизация). Учёт диэлектрической постоянной εпорядка двойки уменьшает Δ
I
.
Для оценок концентрации электронов будем считать Δ
I
= 5 эВ.
Потенциал ионизации свободных молекул, из которых состоят продукты детонации, I
= (12-15) эВ. Эффективный потенциал ионизации будет Ieff
Смотрите также
Определение лигнина
Содержание лигнина в древесине и другом
растительном сырье преимущественно определяют прямыми способами. Они основаны
на количественном выделении лигнина удалением экстрактивных веществ
соо ...
Нитросоединения
...
Получение пурпуреосоли. Аммиакаты кобальта (III)
Подразделение всех химических
соединений на так называемые простые, или атомные, и комплексные, или
молекулярные наметилось, наметилось после создания учения о валентности и
внедрения в хим ...


