Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Термодинамика протекания электродных процессов.
Самопроизвольность протекания окислительно-восстановительных реакций. Связь ЭДС
гальванического элемента с энергией Гиббса. Связь ЭДС с константой равДипломы, курсовые и прочее / Общая и неорганическая химия / Дипломы, курсовые и прочее / Общая и неорганическая химия / Термодинамика протекания электродных процессов.
Самопроизвольность протекания окислительно-восстановительных реакций. Связь ЭДС
гальванического элемента с энергией Гиббса. Связь ЭДС с константой рав Термодинамика протекания электродных процессов.
Самопроизвольность протекания окислительно-восстановительных реакций. Связь ЭДС
гальванического элемента с энергией Гиббса. Связь ЭДС с константой равСтраница 2
В рассматриваемом случае ДG0 = -237,2 кДж/моль и, следовательно, только ∼47 кДж/моль переходит в тепло. Этот пример показывает, что вообще энергию, освобождающуюся при горении природных видов топлива, выгоднее непосредственно преобразовывать в электрическую, так как к. п. д. тепловых машин и тепловых электростанций невелик. Описанный водородно-кислородный элемент является примером так называемых топливных элементов.
Работы по созданию таких элементов получили в последнее время широкое развитие в связи с новыми задачами техники. В этих элементах топливо и окислитель должны храниться отдельно и подаваться к электродам, на которых осуществляются электрохимические реакции. При этом элемент может работать непрерывно, если к нему подводятся реагенты и отводятся продукты реакции, что особенно удобно при использовании жидких и газообразных веществ. Вместо сжигания угля возможно использовать реакцию Ст + О2г = СО2г для получения электрического тока.
Очевидно, что в реальных условиях гальванические элементы работают необратимо, поэтому в работу превращается лишь часть изменения энергии Гиббса реакции, протекающей в элементе. Повторим, что гальванический элемент может работать при условии протекания в нем самопроизвольной химической реакции или какого-либо другого самопроизвольного процесса, сопровождающегося убылью энергии Гиббса.
Если к рассматриваемому гальваническому элементу приложить извне достаточно большую разность потенциалов, превышающую его э. д. с. и имеющую противоположное направление, то будет происходить разложение воды с выделением водорода и кислорода. Таким образом, процессы получения электрического тока в гальванических элементах и электролиза взаимно противоположны.
Особенностью электрохимического процесса в гальваническом элементе является важная для теории возможность его осуществления в условиях весьма близких к обратимости. Это достигается благодаря потенциометрическому методу, в котором э. д. с. изучаемого гальванического элемента практически полностью компенсируется с помощью противоположно направленной э.д. с. внешнего источника. Такой прием позволяет измерять э.д.с. при отсутствии тока в цепи, т.е. когда элемент не работает, а его э.д.с. максимальна. Контроль за отсутствием тока проводят гальванометрами (нуль-инструментами) высокой чувствительности. Они дают отклонение при прохождении тока силой 10-8 - 10-9 А. Такой слабый ток при прохождении через электролит даже в течение многих лет не смог бы выделить сколько-нибудь заметных количеств вещества.
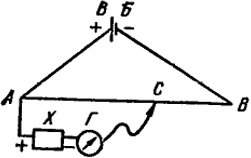
Рис. IX.2. Схема измерения э.д.с. методом компенсации.
Принципиальная схема измерения э. д. с. гальванического элемента компенсационным методом показана на рис. IX.2. Постоянный ток от вспомогательной батареи ВБ подается на концы реохорда АВ - проволоки с постоянным сечением. Поэтому падение напряжения вдоль реохорда пропорционально длине соответствующего отрезка на прямой АВ. С помощью подвижного контакта С можно отбирать произвольную часть падения напряжения между точками А и В. Из рис. IX.2 видно, что напряжение, снимаемое с любого участка реохорда, например АС, направлено навстречу э. д. с. элемента X.
Передвигая контакт С по реохорду, находят такое положение, при котором нуль-гальванометр Г указывает отсутствие тока в цепи АХГС. Это означает, что падение потенциала от ВБ на отрезке АС полностью компенсирует э. д. с. элемента X.
Если э. д. с. вспомогательной батареи ВБ равна ЕБ, то э. д. с. элемента X ЕX определяется из пропорции:
ЕХ/ЕБ = АС/АВ, откуда ЕX = (АС/АВ) ЕБ.
Смотрите также
Ответы
Раздел
1
1. 2. 2. 2.
3. 3. 4. 3. 5. 2. 6. 3. 7. 3.
Раздел
2
1. 3. 2. 2.
3. 2. 4. 4. 5. 3. 6. 1. 7. 2. 8. 1. 9.
4. 10. 2. 11. 3. 12. 2. 13. 2. 14. А‑2, Б‑4,
В‑6, ...


