Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Равновесный состав газа в металлургических реакцияхУчим химию / Учим химию / Равновесный состав газа в металлургических реакциях Равновесный состав газа в металлургических реакцияхСтраница 6
Восстановление оксидов железа монооксидом углерода. На рис. 3 представлен равновесный состав газа в реакциях восстановления Fe3O4 и FeO газом СО. Номера кривых соответствуют номеру уравнения реакции. Для реакций 2, 3 и 4 кривые сходятся в точке "О" c координатами: 570оС и 61 %СО, и в равновесии с газовой фазой находятся металлическое железо, и оксиды FeO и Fe3O4. В системе из трех компонентов (Fe-C-O) равновесие 4 фаз безвариантно ( С = К – f + 1 = 3-4+1=0), поэтому состав газа и температура фиксированы.
Восстановление оксидов железа водородом. На рис. 4 представлен равновесный состав газа в реакциях восстановления FeO и Fe3O4 водородом. Все кривые имеют убывающий характер вследствие эндотермичности реакций. Различный темп кривых вызван разным тепловым эффектом реакций. Координаты безвариантной точки "O1": 570oC – 80 % H2.
Сравнение диаграмм равновесного состава газа в реакциях восстановления оксидов железа водородом и монооксидом углерода представлено на рис. 5 и 6. Для всех оксидов железа равновесные кривые восстановления водородом и монооксидом углерода пересекаются при температуре 810оС. При этой температуре химическое сродство водорода и СО к кислороду одинаково, поэтому водород и монооксид углерода обладают одинаковой склонностью в реакциях восстановления любых оксидов, в частности, FeO, Fe3O4 и Fe2O3. При температуре ниже 810 оС химическое сродство СО к кислороду больше, чем у водорода, поэтому остаточная концентрация газа восстановителя ниже в реакциях восстановления оксидов железа монооксидом углерода. При температурах, превышающих 810 оС, более сильным восстановителем является водород. Его остаточная концентрация в реакциях 1а, 2а и3а меньше, чем у СО в реакциях 1, 2 и 3 (рис. 5 и 6).
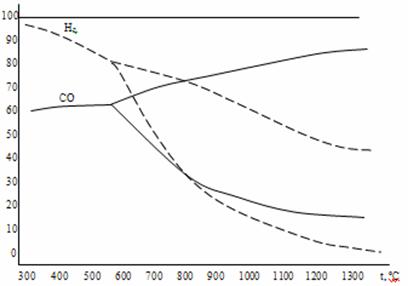
Рисунок 5. Сравнение диаграмм равновесного состава газа в реакциях восстановления оксидов железа водородом и монооксидом углерода.
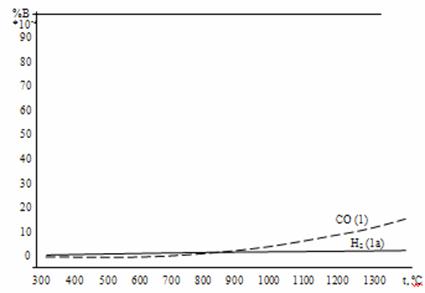
Рисунок 6. Сравнение диаграмм равновесного состава газа в реакциях восстановления оксидов железа водородом и монооксидом углерода.
Восстановление оксидов железа твердым углеродом. Твердый углерод (графит) - универсальный восстановитель оксидов. Реакции восстановления оксидов углеродом графита (коксом) принято называть прямым восстановлением в отличие от реакций восстановления газом, называемых косвенным восстановлением. В доменном процессе доля прямого восстановления оксидов железа составляет 30-40 %. Уравнения реакций:
2в. Fe3O4 + Cтв = 3 FeO + CO
3в. FeO + Cтв = Fe + CO
В трехкомпонентной системе Fe – C – O равновесие четырех фаз (три твердых + газ) одновариантно (С=К-f + n = 3 – 4 +2 = 1) , т.е. состав газа и температура определяются давлением. При Р= const C=0 и равновесие возможно лишь при единственном значении температуры. Равновесное значение температуры можно найти как координату точки пересечения кривой %CОравн = φ(t) на рис. 3 с изобарой реакции Ств + СО2 =2 СО из задачи 2 (рис. 2). Так определяют температуру начала прямого восстановления оксида углеродом. Наложение изобар рисунка 2 на диаграмму рис.3 представлено на рис.7. На этом рисунке видно, что температура начала восстановления конкретного оксида зависит от общего давления, возрастая с его повышением.
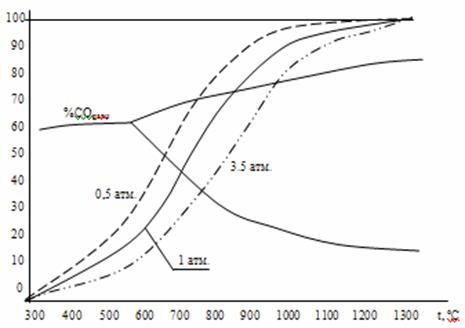
Рисунок 7. Определение температур начала восстановления Fe3O4 и FeO твердым углеродом.
Смотрите также
Процесс компаундирования нефтепродуктов
Промышленное
производство
нефтепродуктов состоит из следующих основных этапов: первичная, вторичная
переработка нефти и процессы смешения (компаундирования).
Первичная
переработка
(пря ...
Влияние добавок на устойчивость пероксида водорода в водных растворах
В настоящее время
пероксид водорода H2O2 находит широкое применение,
особенно в медицине, где его используют в качестве:
- антисептика в
концентрации 3%;
- стерилизующего
агента в ко ...


