Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Процессы, механизмы и кинетические модели в синтетической химииУчим химию / Учим химию / Процессы, механизмы и кинетические модели в синтетической химии Процессы, механизмы и кинетические модели в синтетической химииСтраница 3
Скорость реакции описывается уравнением
![]()
где FMo = 1 + KГПЭБ[ГПЭБ] + KМФК[МФК] + KОП[ОП] + KH2O[H2O] есть закомплексованность катализатора, МФК – метилфенилкарбинол, ОП – пропиленоксид. Ki – константы равновесия образования соответствующих комплексов Mo. Как видно из уравнения, процесс протекает с лимитирующей стадией, переходное состояние которой включает ГПЭБ, Mo(VI) и пропилен. Показано, что активным катализатором является пропиленгликолятный комплекс Mo(VI), реакция которого с ГПЭБ и C3H6 приводит к ОП.
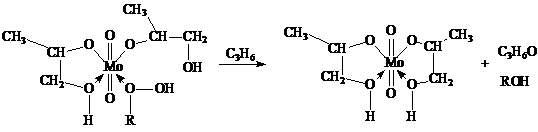
Окисление спиртов. Окисление (или окислительное дегидрирование) спиртов на металлических и окисных катализаторах до альдегидов и кетонов является важным промышленным процессом.
Рассмотрим подробнее процесс окисления метанола до формальдегида
![]()
В промышленности реализованы два варианты процесса окисления:
на оксидах MoO3-Fe2O3 (и др. оксидных катализаторах) процесс протекает в кинетической области при 300 – 350оС и 15-кратном избытке воздуха по отношению к метанолу. При этом достигаются 100% превращение спирта, высокая селективность и синтез безметанольного формальдегида, необходимого для процессов его полимеризации.
На серебряных катализаторах (мелкокристаллическое серебро, Ag/пемза, Ag/a-Al2O3 и др.) процесс протекает в адиабатическом режиме в тонком слое катализатора (8 – 10 см) во внешнедиффузионной области. Количество подаваемого кислорода ~0.9 от стехиометрии.
И основная реакция, и побочная реакция
![]()
– экзотермические процессы. Эндотермический процесс дегидрирования, который имеет место в условиях процесса
![]()
не компенсируют большого количества выделяющегося тепла. Поэтому при низких температурах (220 – 250оС) процесс протекает в кинетическом режиме, однако при больших нагрузках по спирту и небольшом количестве воздуха процесс не удерживается в изотермическом режиме, и начинается быстрый подъем температуры, обусловленный плохим отводом тепла и повышением температуры зерна катализатора Тз. Повышение Тз вызывает экспоненциальный рост скорости, рост количества выделяющегося тепла qподв (ккал/(л·час)) и еще больший рост Тз, который останавливается в новом стационарном состоянии при высоком градиенте Тз – Tf (Tf – температура газа), обеспечивающем равенство отводимого и подводимого тепла qподв @ qотв. Таким образом:
в области низких температур Тз @ Tf, qподв @ qотв, процесс протекает в кинетической области (область i);
при повышении Тз возникает неустойчивый режим (область n);
при Тз > Tf режим адиабатический (qподв @ qотв), внешнедиффузионная область, режим "зажигания", работает тонкий слой катализатора (область k).
Температуру адиабатического разогрева можно оценить по уравнениям
![]() ;
; ![]() ,
,
Смотрите также
Получение гидроксида натрия каустификацией содового раствора
Гидроксид натрия (каустическая сода) используется
во многих отраслях промышленности: химической, металлургической, нефтеперерабатывающей,
мыловаренной, фармацевтической, целлюлозно-бумажной, ...
Характеристика химического элемента №16 (Сера)
...
Происхождение ископаемых углей
Практически невозможно установить точную дату,
но десятки тысяч лет назад человек, впервые познакомился с углём, стал
постоянно соприкасаться с ним. Так, археологами найдены доисторические
...


