Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Концентрация растворовОткрытая химия / Растворы / Открытая химия / Растворы / Концентрация растворов Концентрация растворовСтраница 2
где nЭ (B) – количество вещества эквивалентов, μЭ – молярная масса эквивалента. l Титр раствора вещества B (TB) определяется массой растворенного вещества в г, содержащегося в 1 мл раствора:
| |
| |
Массовые концентрации (массовая доля, процентная, моляльная) не зависят от температуры; объемные концентрации относятся к определенной температуре.
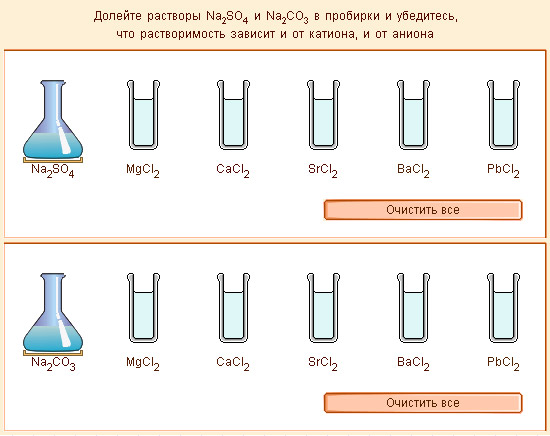
Все вещества в той или иной степени способны растворяться и характеризуются растворимостью. Некоторые вещества неограниченно растворимы друг в друге (вода–ацетон, бензол–толуол, жидкие натрий–калий). Большинство соединений ограниченно растворимы (вода–бензол, вода–бутиловый спирт, вода–поваренная соль), а многие малорастворимы или практически нерастворимы (вода–BaSO4, вода–бензин).
|
|
|
Модель 6.2. Растворимость солей |
Растворимостью вещества при данных условиях называют его концентрацию в насыщенном растворе. В таком растворе достигается равновесие между растворяемым веществом и раствором. В отсутствие равновесия раствор остается стабильным, если концентрация растворенного вещества меньше его растворимости (ненасыщенный раствор), или нестабильным, если в растворе содержится вещества больше его растворимости (пересыщенный раствор).
Смотрите также
Бутадиен-стирольные каучуки, получаемые в растворе и эмульсии
Бутадиен-стирольные каучуки (дивинил-стирольные каучуки, БСК,
СКС, СКМС, ДССК, америпол, интол, карифлекс, крилен, нипол, плайофлекс, SBR,
синпол, солпрен, стереон, тьюфден, филпрен, юниден) ...
Равновесие между жидкостью и паром
...
Зелинский Николай Дмитриевич
Есть личности, которые олицетворяют собой динамику развития общества и
определяют поступательное движение общественной жизни на многие годы. Право
стать личностью приобретается умением, буду ...