Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Определение массовой доли веществаУчим химию / Учим химию / Определение массовой доли вещества Определение массовой доли веществаСтраница 4
ra(H2)ζ ra(NaH) ж 1,75 моль.
4. Сравним количество вещества N2 и H2. По уравнению:
![]()
а имеем 0,5 моль, следовательно, азот прореагирует полностью.
5. Вычислим массу аммиака:
ra(NH3)ζ 2ra(N2)ζ 1моль; то(NH3)ζ 1 моль ■ 17 г/моль ж 17 г — на столько увеличится масса раствора азотной кислоты. Ответ:![]() ж 17 г.
ж 17 г.
Задача 8. К раствору хлорида железа, содержащему 13,0 г соли, прибавили избыток гидроксида калия. При этом образовался осадок массой 8,56 г. Определите валентность железа в хлориде.
Решение
1. Известны нераствормые гидроксиды железа(11) и железа(Ш). Обозначим валентность железа в хлориде через,:
![]()
2. Выразим через & количество вещества соли и гидроксида железа:
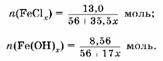
3. вставим уравнение:
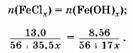
Pешая уравнение, получаем, что валентность железа в хлориде равна III.
Oтвет: III.
Задача 9. Cмесь металла и сульфида данного металла полностью растворилась в 10%-ной соляной кислоте, при этом выделилось 11,2 л (н. у.) газа. При добавлении к образовавшемуся раствору раствора красной кровяной соли образуется осадок синего цвета. При пропускании выделившегося газа через избыток раствора нитрата свинца образуется 47,8 г осадка черного цвета. Oпределите массовые доли компонентов смеси.
Pешение
1. Исходная смесь полностью растворилась в соляной кислоте, следовательно, и металл, и сульфид данного металла прореагировали нацело. Взаимодействие с красной кровяной солью с образованием осадка синего цвета (турнбулевой сини) — качественная реакция на катион Fe2K, следовательно, металл — железо, сульфид металла — FeS:
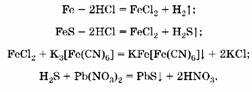
2. Hайдем массу сульфида железа: 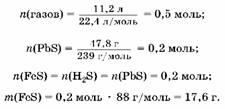
3. Oпределим массу железа:
Ai(H2) = га(газов) - Ai(H2S); Ai(H2) = 0,5 моль - 0,2 моль = 0,3 моль; Ai(Fe) = (H2) = 0,3моль; An(Fe) = 0,3 моль ■ 56 г/моль = 16,8 г.
4. Вычислим массовые доли компонентов смеси:
т(см.) = 16,8 г K 17,6 г = 34,4 г;
![]()
M(Fe) = 100%- 51,16%=48,84%. Oт в е т: M(Fe) = 48,84%; M(FeS) = 51,16%.
Задача 6.334. Cмесь железа и магния обработали концентрированной серной кислотой и собрали газ объемом 1,68 л (н. у.). ^ра-створившийся остаток отделили и обработали разбавленной азотной кислотой, при этом остаток полностью растворился. Полученный раствор осторожно выпарили, соль прокалили. Масса твердого остатка составила 12 г. Oπределите количественное соотношение металлов в смеси.
Pешение
1. Железо при обычных условиях с концентрированной серной кислотой не взаимодействует, но растворяется в разбавленной азотной кислоте с образованием нитрата железа(Ш):
Смотрите также
Растворение твердых веществ
Тема контрольной работы
«Растворение твердых веществ» по дисциплине «Химическая
технология неорганических веществ».
Под термином растворение
понимают гетерогенные реакции, протекающие ме ...
Новые сложные гребнеобразные полиэфиры и полиамиды: синтез, структура и свойства
...
Использование озона
Озон -
высокоэффективное и универсальное окисляющее вещество, которое используется в
обработке воды в целях дезинфекции, удаления марганца и железа, улучшения
вкуса, устранения цвета и запа ...


