Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Определение массовой доли веществаУчим химию / Учим химию / Определение массовой доли вещества Определение массовой доли веществаСтраница 3
Oтвет: MJ(Cr2O3) = 81,72%.
Задача 6. Cмесь хлоридов алюминия и хрома(Ш) массой 317 г обработали сначала избытком раствора гидроксида калия, а затем — избытком хлорной воды. К полученному раствору прилили избыток нитрата бария, при этом образовалось 126,5 г осадка желтого цвета. Рассчитайте массовую долю хлорида хрома(Ш) в исходной смеси.
Pешение
1. В избытке щелочи образуются гидроксокомплексы и алюминия, и хрома(Ш), но с хлорной водой реагирует только гидроксо-комплекс хрома(Ш):
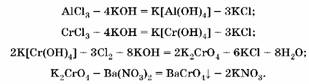
2. По количеству хромата бария (осадок желтого цвета) рассчитаем количество вещества, массу и массовую долю CrCl3:
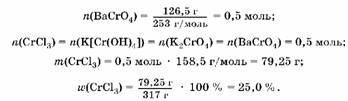
Oтвет: M(CrCl3) = 25,0%.
Задача 7. При гидролизе средней соли образовалось 20,4г вещества H2X, массовая доля водорода в котором равна 5,88%, и 41,2 г вещества M(OH)3, массовая доля M в котором равна 50,49%. Oпределите формулу соли.
Pешение
1. Для определения элемента X находим массу и количество вещества элементов водорода и X, содержащихся в 20,4 г вещества H2X, а также молярную массу элемента X:
![]()
m(X) = 20,4 г - 1,2 г = 19,2 г;
![]()
![]()
следовательно, X — это сера.
2. Определяем массу элемента М:
![]()
то(М)ж41,2г 0,5049ж20,8 г.
3. Так как количество вещества элемента М и количество вещества M(OH)3 равны, то составим уравнение и определим элемент М, обозначив его молярную массу через
![]()
Решая уравнение, находим, что - = 52 г/моль, следовательно, элемент М — это хром.
4. Для определения формулы соли необходимо знать количество вещества элементов серы и хрома:
![]()
следовательно, формула соли Cr2S3. Ответ: Cr2S3.
Задача 7. Газ, образовавшийся при разложении дихромата аммония массой 126 г, смешали с газом, выделившимся при растворении 42 г гидрида натрия в 900 мл 2 M раствора хлороводорода, и пропустили при соответствующих условиях над никелевым катализатором. Продукт реакции растворили в избытке раствора азотной кислоты. Рассчитайте, насколько увеличится масса раствора азотной кислоты.
Решение
1. Масса азотной кислоты увеличивается за счет поглощения аммиака, который образуется при соответствующих условиях из водорода и азота:
(1) (2)
(3) 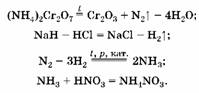 (4)
(4)
2. Найдем количество вещества азота:
![]()
3. Определим количество вещества водорода:
![]()
ra(HCl) ж 2 моль/л 0,9 л ж 1,8 моль — избыток, значит, количество вещества водорода определяем по NaH:
Смотрите также
Разработка процесса производства изопропилбензола на ОАО "Омский каучук"
...
Бутадиен-стирольные каучуки, получаемые в растворе и эмульсии
Бутадиен-стирольные каучуки (дивинил-стирольные каучуки, БСК,
СКС, СКМС, ДССК, америпол, интол, карифлекс, крилен, нипол, плайофлекс, SBR,
синпол, солпрен, стереон, тьюфден, филпрен, юниден) ...
Губчатые изделия
Тема данной курсовой работы «Губчатые изделия», эта тема довольно
актуальна, так как производство губчатых изделий занимает не маловажное место в
промышленности. Потому что эти изделия имеют ...


