Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Порядок химических реакцийОткрытая химия / Химическая кинетика / Открытая химия / Химическая кинетика / Порядок химических реакций Порядок химических реакцийСтраница 2
Решения кинетических уравнений 2-го и 3-го порядка, приведенные в таблице 5.1, справедливы только при равных начальных концентрациях веществ
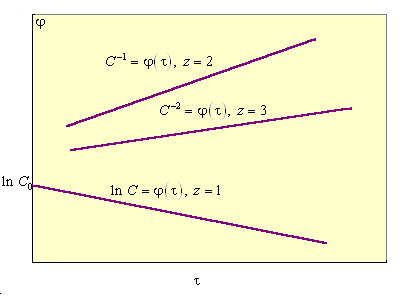
В каждом случае кинетическое уравнение линейно в соответствующих координатах С(τ), что позволяет графически определить порядок реакции (рис. 5.2).
 |
|
Рисунок 5.2 Зависисмости C = f (τ) для реакций первого, второго и третьего порядков |
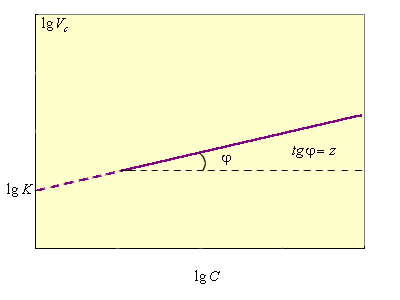
Прологарифмировав уравнение (5.2), получим lg V = lg K + z lg C; из графической зависимости (рис. 5.2) получаем lg K и z = tg φ.
Порядок реакции, особенно гетерогенной, может быть не только целочисленным (в том числе и нулевым), но и дробным. Нулевой порядок реакции указывает на постоянство скорости во времени.
Для гетерогенной реакции C(тв) + О2(г) = СО2(г) можно создать концентрационнные условия, при которых порядок реакции будет меняться в пределах от нуля до единицы. Действительно, при больших парциальных давлениях кислорода ![]() в приповерхностном слое твердого углерода большой концентрационный градиент способствует практически мгновенному восполнению прореагировавшего кислорода. Следствием этого оказывается постоянство скорости реакции по кислороду, поскольку
в приповерхностном слое твердого углерода большой концентрационный градиент способствует практически мгновенному восполнению прореагировавшего кислорода. Следствием этого оказывается постоянство скорости реакции по кислороду, поскольку ![]() ~ const. Поэтому реакция горения углерода будет в этих условиях подчиняться кинетическому уравнению нулевого порядка. При уменьшении парциального давления кислорода, начиная с некоторого
~ const. Поэтому реакция горения углерода будет в этих условиях подчиняться кинетическому уравнению нулевого порядка. При уменьшении парциального давления кислорода, начиная с некоторого скорость реакции будет соответствовать кинетическому уравнению первого порядка
При промежуточных давлениях кислорода порядок реакции изменяется в интервале от 0 до 1.
 |
|
Рисунок 5.3 Зависимость V = f (lg C) |
Смотрите также
Энтальпия и ее отношение к теплоте химической реакции. Типы химических связей
...
Бериллий
Соединения бериллия
в виде драгоценных камней были известны еще в древности. С давних пор люди
искали и разрабатывали месторождения аквамаринов, изумрудов и бериллов. Есть
свидетельс ...


