Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Порядок химических реакцийОткрытая химия / Химическая кинетика / Открытая химия / Химическая кинетика / Порядок химических реакций Порядок химических реакцийСтраница 1
Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности элементарные химические реакции делятся на молекулярные (А →) и бимолекулярные (А + В →); тримолекулярные реакции встречаются чрезвычайно редко.
Если реакция протекает последовательно через несколько гомогенных или гетерогенных элементарных стадий, то суммарная скорость всего процесса определяется самой медленной его частью, а молекулярность заменяется порядком реакции – формальным показателем при концентрации реагирующих веществ. Поэтому весь процесс в целом лучше характеризует порядок реакции.
Кинетическое уравнение реакции только для элементарных стадий совпадает с выражением ЗДМ. В этих случаях молекулярность и порядок реакции совпадают, хотя и не всегда. Так, при избытке одного из компонентов элементарной реакции А + В (А >> В) скорость реакции будет практически зависеть от изменения концентрации вещества В (А = const), поэтому порядок бимолекулярной реакции понижается до первого. Аналогично тому, что скорость реакции может характеризоваться по любому веществу, участвующему в реакции, для реакции aА + bВ → кинетические уравнения по веществу А и веществу В выглядят соответственно
| |
а общее кинетическое уравнение –
|
(5.2) |
Здесь z = x + y – общий порядок реакции. Запишем кинетическое уравнение в дифференциальной форме для разных исходных реагентов:
| |
Разделение переменных и интегрирование в пределах от нуля до τ дает приведенные в таб. 5.1 уравнения для реакций первого, второго и третьего порядков.
| ||||||||||||
|
Таблица 5.1 Кинетические уравнения и период полупревращения реакций первого, второго и третьего порядков |
Смотрите также
Гидроксикарбонильные соединения. Дикарбоновые кислоты
a-Гидроксикарбонильные
соединения, как уже отмечалось, могут быть получены окислением диолов
гипобромитом натрия или реагентом Фентона.
Для
a-гидроксикарбонильных
соединений характерна ...
Огнестойкие композиции на основе полибутилентерефталата
"В химии нет отходов, есть только
неиспользованное сырье" Д. И. Менделеев.
Как известно, развитие современной техники
невозможно без исследования пластических масс, в особенност ...
Свойства кальция
...



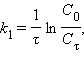 [с–1]
[с–1] 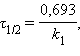 [с–1]
[с–1] 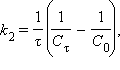 [л∙моль∙с–1]
[л∙моль∙с–1] 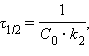 [л∙моль–1∙с–1]
[л∙моль–1∙с–1] 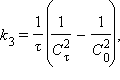 [л2∙моль–2∙с–1]
[л2∙моль–2∙с–1] 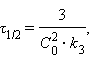 [л2∙моль–2∙с–1]
[л2∙моль–2∙с–1]