Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Ковалентная связьСтраница 1
Тип химической связи между атомами, возникающей при обобществлении электронов, которые принадлежат этим атомам.
Для объяснения ковалентной связи используют 2 метода квантово-механического расчета:
1. метод валентных связей (МВС)
2. метод молекулярных орбиталей (ММО)
Согласно методу валентных связей ковалентная связь образуется не путем передачи, а путем обобществления неспаренных электронов с антипараллельными спинами по 1-му от каждого атома. Образовавшаяся в этом случае электронная пара принадлежит обоим атомам. ![]()
![]() −
−![]() – обозначение ковалентной связи.
– обозначение ковалентной связи.
Чем в большей степени перекрываются атомные орбитали, тем прочнее связь.
Перекрывание атомных орбиталей возможно лишь при их определенной взаимной ориентации в пространстве.
Ковалентная связь в отличие от ионной имеет направленность.
Атомные орбитали могут перекрываться двумя способами:
1-ый способ: перекрывание в направлении главных осей (осей, связывающих ядра).


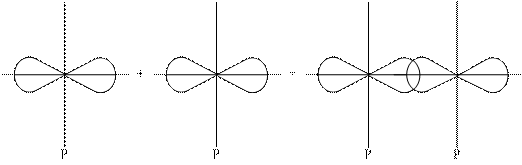
Образовавшаяся при этом перекрывании ковалентная связь называется s-сигма связь.
2-ой способ: P-орбитали с параллельными осями.
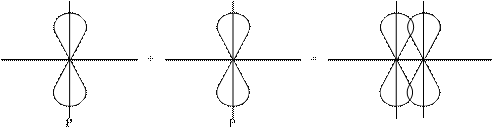
Боковое перекрывание образует p-связь, менее прочную связь чем s- сигма. В соответствии с правилом Паули между двумя атомами может быть либо 1s-сигма связь, либо 1s-сигма и 1p-связь, либо 1s-сигма и 2p-связи.
![]() Связи:
Связи:
![]() одинарная 1s −
одинарная 1s −
![]() двойная 1s+1p =
двойная 1s+1p =
![]() тройная 1s+2p ≡
тройная 1s+2p ≡
При увеличении кратности, длина уменьшается:
одинарная – 1,54 ![]()
двойная – 1,34 ![]()
тройная – 1,2 ![]()
Так как нахождение 2-х электронов в поле действия 2-х ядер энергетически выгоднее, чем пребывание каждого электрона в поле своего ядра, то в образовании ковалентной связи принимает участие все одноэлектронные орбитали внешнего энергетического уровня. Например, атом азота имеет три неспаренных электрона на внешнем уровне и может образовывать за счет таких электронов 3 ковалентных связи:
N 2P
![]()
![]()
![]()
![]()
![]() 2S ↑ ↑ ↑
2S ↑ ↑ ↑
![]()
![]() ↓↑
↓↑
![]()
Число неспаренных электронов может увеличиваться при переходе атома в возбужденное состояние за счет “расспаривания”: у ![]() в этом случае атом способен образовывать 4 связи. “Расспаривание” электрона требует затраты энергии, которая компенсируется при образовании связей.
в этом случае атом способен образовывать 4 связи. “Расспаривание” электрона требует затраты энергии, которая компенсируется при образовании связей.


