Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
ЭнтропияОткрытая химия / Химическая термодинамика / Открытая химия / Химическая термодинамика / Энтропия ЭнтропияСтраница 1
Изменение энтальпии системы не может служить единственным критерием самопроизвольного осуществления химической реакции, поскольку многие эндотермические процессы протекают самопроизвольно. Иллюстрацией этого служит растворение некоторых солей (например, NH4NO3) в воде, сопровождающееся заметным охлаждением раствора. Необходимо учитывать еще один фактор, определяющий способность самопроизвольно переходить из более упорядоченного к менее упорядоченному (более хаотичному) состоянию.
Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Возможность протекания эндотермических процессов обусловлена изменением энтропии, ибо в изолированных системах энтропия самопроизвольно протекающего процесса увеличивается ΔS > 0 (второй закон термодинамики).
|
|
|
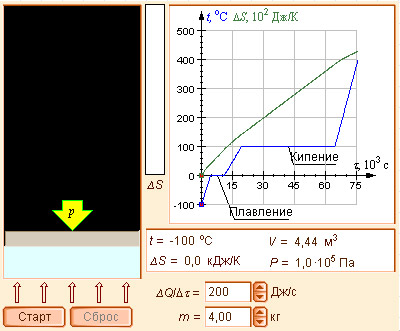
Модель 4.8. Энтропия и фазовые переходы |
Л. Больцман определил энтропию как термодинамическую вероятность состояния (беспорядок) системы W. Энтропия связана с термодинамической вероятностью соотношением:
|
Размерность энтропии 1 моля вещества совпадает с размерностью газовой постоянной R и равна Дж∙моль–1∙K–1. Изменение энтропии *) в необратимых и обратимых процессах передается соотношениями ΔS > Q / T и ΔS = Q / T. Например, изменение энтропии плавления равно теплоте (энтальпии) плавления ΔSпл = ΔHпл/Tпл. Для химической реакции изменение энтропии аналогично изменению энтальпии
| |
*) термин энтропия был введен Клаузиусом (1865 г.) через отношение Q / T (приведенное тепло).
Здесь ΔS° соответствует энтропии стандартного состояния. Стандартные энтропии простых веществ не равны нулю. В отличие от других термодинамических функций энтропия идеально кристаллического тела при абсолютном нуле равна нулю (постулат Планка), поскольку W = 1.
Энтропия вещества или системы тел при определенной температуре является абсолютной величиной. В табл. 4.1 приведены стандартные энтропии S° некоторых веществ.
| ||||||||||||||||||||||||||||||||||||||||||||
|
Таблица 4.1 Стандартные энтропии некоторых веществ |
Смотрите также
Разработка методики определения ультрамикрограммовых количеств тяжелых металлов методом инверсионной вольтамперометрии
Актуальность.
Современный уровень развития технологии, биологии, медицины, охраны окружающей
среды и других областей науки и техники выдвигает задачу определения малых
количеств веществ во ...
Технология приготовления косметических гелей
На
фоне довольно высоких темпов развития химической промышленности сегодня
ученому-исследователю очень трудно уследить за тенденциями развития
производства косметической продукции еще и по ...
Химический анализ электролита ванн хлорирования на машиностроительном заводе
...