Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кинетическая кислотностьОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Кинетическая кислотность Кинетическая кислотностьСтраница 2
Если же нет подобных пространственных эффектов или внутримолекулярных водородных связей, то перенос протона между электроотрицательными атомами происходит быстро. Важная особенность СН-кислот состоит в том, что перенос протона от атома углерода, как правило, осуществляется медленно даже в отсутствие пространственных затруднений, так как СН-кислоты исключительно плохие доноры водородной связи (разд. 3.3.3). Это иллюстрируют две последние реакции в табл. 3.16.
Поскольку СН-кислоты медленно отдают протон, их иногда называют "псевдокислотами", в отличие от "нормальных" ОН- и NH-кислот. Термин "псевдокислота" предложил Ганч (1899 г.), впервые исследовавший действие щелочей на нитрометан (реакция № 9 в табл. 3.16).
Неспособность СН-кислот (и С-оснований) образовывать сильные водородные связи - это лишь одна из причин замедленного переноса протона. Вторая причина связана с тем, что при ионизации большинства СН-кислот происходит значительная перестройка их молекул. Связь С-Н принципиально не кислая, и относительно сильные СН-кислоты своими кислотными свойствами во многом обязаны наличием в их молекулах определенных функциональных групп, которые способны тем или иным способом принимать на себя электронную пару, остающуюся на атоме углерода после ухода протона. Такая делокализация изменяет длины связей и углы между связями и требует затраты дополнительной энергии, что понижает скорость отщепления протона.
Третья причина связана с перестройкой (реорганизацией) окружающего растворителя. Любая ионная реакция в полярной среде сопровождается движением молекул растворителя в новые положения, которые диктуются перераспределением заряда. Чем больше движение заряда, тем больше перестройка растворителя и связанные с этим энергетические затраты. Поскольку отрыв протона от СН-кислот сопровождается сильным смещением заряда к функциональной группе, перестройка растворителя будет существенной.
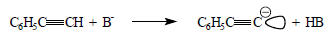
В тех случаях когда ионизация СН-кислот не сопровождается делокализацией заряда, перенос протона не замедляется, и эти соединения ведут себя как "нормальные" кислоты. Примером является фенилацетилен:
В карбанионе С6Н5С≡С- sp-гибридная орбиталь, несущая отрицательный заряд ортогональна π-орбиталям тройной связи, и поэтому делокализации заряда на π-системе быть не может. С другой стороны, в анионе дицианметана (малонитрила) делокализация возможна:
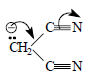
но это соединение по неясной причине введет себя как "нормальная" кислота. Приведенные примеры являются исключениями, а правило состоит в том, что СН-кислоты проявляют себя как "псевдокислоты", т.е. отдают протон основаниям с медленной скоростью.
Поскольку перенос протона от СН-кислот к основаниям является меделенным процессом, его скорость легко можно измерить обычными несложными кинетическими методами. Для этой цели используют реакцию изотопного обмена водорода под действием основания в протонных растворителях. Обычно в качестве основания берут соль, содержащую лиатный ион (анион, сопряженный растворителю). Обмен можно проводить или с меченой СН-кислотой в немеченом ("легком") растворителе, либо с немеченой СН-кислотой в меченом растворителе:
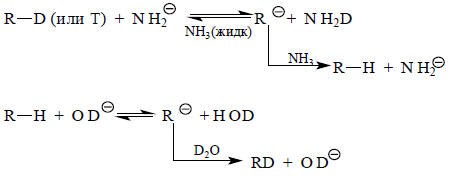
Используя принцип стационарности (разд. 3.3.6.а), для реакции СН-кислоты RD с основанием В- в растворителе НВ можно записать:
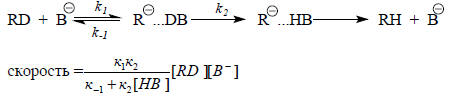
Если к2>>k-1, а НВ - молекула растворителя, то
скорость≅к1[RD][B-].
Тогда наблюдаемая скорость обмена дейтерия на легкий водород приближенно равна скорости стадии ионизации СН-кислоты: кнабл . Численное значение логарифма константы скорости к1 называется кинетической кислотностью соединения. Соотношение между кинетической и равновесной (термодинамической) кислотностью устанавливается уравнением Бренстеда (разд. 3.3.7):
Смотрите также
Алюминий
АЛЮМИНИЙ (лат. Aluminium; от "alumen" —
квасцы), Al, химический элемент III группы периодической системы, атомный номер
13, атомная масса 26,98154.
...
Экспериментальная часть
Реагенты
и оборудование.
Уравнение
реакции имеет вид:
Реактивы:
N-фенилантраниловая кислота (С13Н11О2N, M=213 г/моль, Тпл=179-1810С) – 3г,
серная кислота (Н2SО4, M=98.08 г/моль, Тпл=-13 ...
Комплексные соединения в аналитической химии
Обширную группу
химических соединений составляют комплексы, в молекулах которых всегда можно
выделить центральный атом или ион, вокруг которого сгруппированы другие ионы
или молекулярные гр ...


