Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Общий кислотный и общий основной катализОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Общий кислотный и общий основной катализ Общий кислотный и общий основной катализСтраница 1
Скорость реакций, катализируемых кислотами и основаниями, не во всех случаях контролируется только значением рН раствора. Например, гидролиз этилового эфира ортоуксусной кислоты в мягких условиях можно остановить на стадии этилацетата:
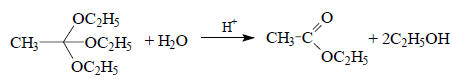
Эта реакция катализируется кислотами, но не катализируется основаниями. В мета-нитрофенолятном буферном растворе при фиксированном значении рН скорость реакции не постоянна, а увеличивается при концентрации буфера*. Это означает, что кроме Н3О+ реакция катализируется также недиссоциированным мета-нитрофенолом (АН). Общая скорость, таким образом, является суммой скоростей параллельных реакций, одна из которых катализируется Н3О+, другая АН, а третья, "некаталитическая", реакция на самом деле катализируется самой водой:
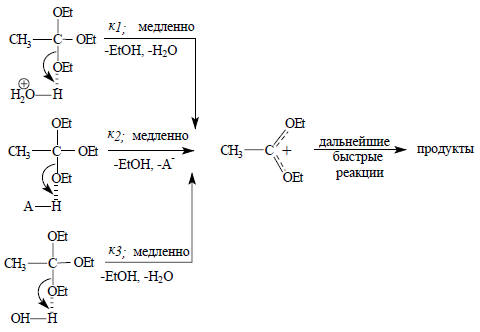
В данном случае к1=2,1.104, к2=1,7.10-3 и к3=10-7 л/моль.с.
Рассмотренная реакция является примером общего кислотного катализа, который характеризуется тем, что катализатором является любая кислота (мета-нитрофенол, вода), присутствующая в растворе, а не только сопряженная кислота растворителя (Н3О+). Наблюдаемая константа скорости в случае общего кислотного катализа, таким образом, определяется выражением
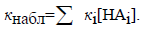
Аналогично, общий основной катализ описывается уравнением
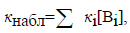
где Вi - каждое конкретное основание, содержащееся в растворе. Примером такой реакции является гидролиз уксусного ангидрида в водном ацетатном буфере:
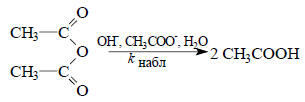
Общий кислотный катализ обычно проявляется в том случае, когда перенос протона между субстратом и основанием является медленным процессом. Как правило, это характерно для СН-кислот и С-оснований (см. разд. 3.5.1). Рассмотрим несколько хорошо исследованных примеров.
Известно, что образование енолят-анионов, например, из ацетальдегида является медленным процессом:
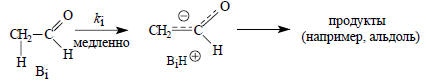
Это приводит к кинетическому уравнению
скорость=кi[RH][Вi],
где RH - органический субстрат, в данном случае ацетальдегид, являющийся СН-кислотой. Если в растворе содержится несколько оснований Вi, то каждое из них катализирует реакцию путем отщепления протона от RH с собственной скоростью. Общая скорость реакции будет суммой скоростей этих отдельных реакций.
В кислотном гидролизе виниловых эфиров медленной стадией является присоединение протона по двойной связи, т.е. С-протонирование:
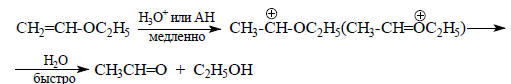
В этом случае действует общий кислотный катализ.
При енолизации ацетальдегида в буферных растворах сначала происходит быстрое протонирование по кислороду, а затем медленный перенос протона от углерода к основанию Аi-:
![В этом случае скорость=к1к2[R][H3O+][Аi-].](images/books/295/index.27.jpg)
В этом случае скорость=к1к2[R][H3O+][Аi-].
Смотрите также
Разработка технологии полимеризационного наполнения ПКА дисперсными наполнителями
В
настоящее время рынок потребления высоконаполненных композиционных
магнитотвёрдых материалов, к которым относятся так называемые магнитопласты,
является одним из самых динамичных в промыш ...
Характеристика стихийных бедствий
Землетрясения - это сильные колебания земной коры, вызываемые тектоническими или вулканическими причинами и приводящие к разрушению зданий, сооружений, пожарам и человеческим жертвам.
Важнейшая ...
Компьютерные технологии при изучении темы "Молекулярные перегруппировки"
В Государственной
программе развития образования России на 2005-2010 годы отмечается, что в
условиях быстроизменяющегося мира и увеличения потоков информации
фундаментальные предметные знан ...


