Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кислотность и основность в газовой фазеОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Кислотность и основность в газовой фазе Кислотность и основность в газовой фазеСтраница 2
На рис. 3.8 данные табл. 3.9 показаны в виде графика. Видно, что в целом никакой корреляции между кислотностью в газовой фазе и в воде нет. Тем не менее определенную симбатность можно найти, если рассматривать различные классы бренстедовских кислот по отдельности. Так, для галогеноводородных кислот (прямая а) порядок изменения кислотности как в воде, так и в газовой фазе один и тот же: HI>HBr>HCl>HF. Различие состоит в том, что интервал изменения рКа в воде приблизительно в 4 раза уже, чем в газовой фазе. Это связано с тем, что в воде протон и галогенид-ионы очень хорошо сольватированы, и вследствие этого сила кислот нивелируется (разд. 3.3.3.в).
Таблица 3.9
Термодинамика газофазной кислотной диссоциации
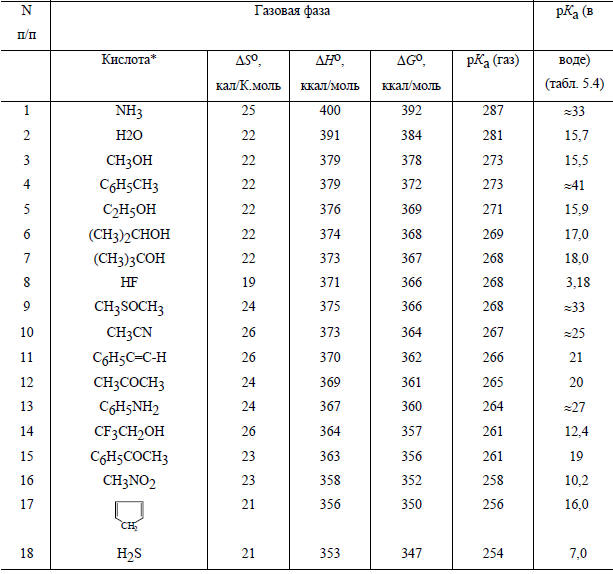
* Названия органических кислот даны в табл. 3.2.
** Рассчитано по уравнению
Прямая в соответствует ионизации СН-кислот; наклон этой прямой dpKa(газ)/dpKa(H2O)≈0,8, т.е. близок к единице. Вероятно, так и должно быть, поскольку вода плохо сольватирует как сами СН-кислоты, так и отрицательно заряженные карбанионы, поскольку связи С-Н и анионные центры С- мало склонны к образованию водородных связей (разд. 3.3.3.в). Кроме того, карбанионы, соответствующие СН-кислотам, рКа которых можно определить в водном растворе, как правило, характеризуются делокализованным по π-системе зарядом (мягкие основания), что уменьшает их склонность сольватироваться водой (жесткая кислота). Следовательно влияние сольватации в случае СН-кислот не так велико , и наклон близок к единице.
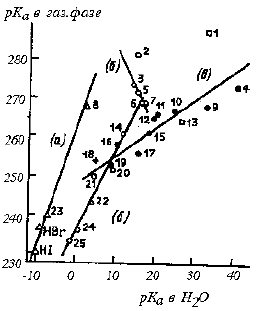
Рис. 3.8. Сравнение рКа в газовой фазе и воде. Номера точек соответствуют соединениям из табл. 3.9. Прямые: а - для HHal; б - для ОН-кислот; в - для СН-кислот. Для HBr и HI значения рКа рассчитаны с предположением, что ΔGo≈ΔНo
Но самые интересные выводы можно сделать из прямой б для ОН-кислот. Эта прямая имеет излом. В нижней части наклон прямой положителен, т.е. кислотность в газовой фазе и в воде уменьшается в одном и том же ряду:
HNO3>CHCl2COOH>C6H5COOH>CH3COOH>C6H5OH>CF3CH2OH>AlkOH
В верхней части наклон отрицателен, т.е. кислотность в газовой фазе и в воде изменяется в противоположных направлениях. на верхней части прямой б расположены вода и простые алкиловые спирты. В водном растворе кислотность уменьшается в ряду
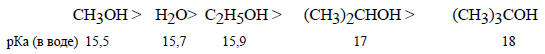
Одно время считалось, что это связано с электронным эффектом метильных групп, так как при последовательном замещении атомов водорода в метильной группе метанола на метильные группы, обладающие (+I)-эффектом (раздел 2.2.1), алкоксидные ионы (сопряженные основания спиртов) должны дестабилизироваться, т.е. становиться более сильными основаниями. Однако в газовой фазе последовательности иная:
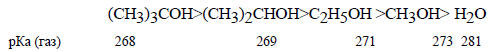
Эту последовательность нельзя объяснить (+I)-эффектом алкильных групп, который увеличивается в ряду
СН3 < С2Н5 < изо-С3Н7 < трет-С4Н9
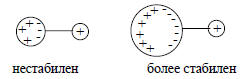
Считается, что в газовой фазе главную роль играет внутримолекулярное взаимодействие отрицательного заряда (на атоме кислорода) с индуцированным под действием этого заряда диполем неполярной, но поляризуемой алкильной группы. Чем больше объем алкильной группы, тем она легче поляризуется (разд. 2.1.2), т.е. тем более способна взаимодействовать с отрицательным зарядом на кислороде:
Эта модель подтверждается тем, что в газовой фазе кислотность протонированных аминов уменьшается в ряду
CH3NH3+ > C2H5NH3+ > (CH3)2CHNH3+ > (CH3)3CNH3+.
В данном случае объемистые алкильные группы стабилизируют уже не анион, а катион, т.е. недиссоциированную кислоту:
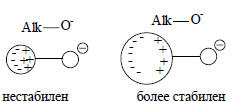
Следовательно, в газовой фазе увеличение объема алкильной группы должно уменьшать кислотность солей аммония ( т.е. увеличивать основность аминов), что и наблюдается.
Результаты, полученные в газовой фазе, показывают, что обращение ряда кислотности спиртов в воде (а также "неправильное" положение воды в ряду кислотности между метанолом и этанолом) связано исключительно с сольватацией, сила которой превосходит силу взаимодействия "ион-индуцированный диполь"
Смотрите также
Фальсификация бензинов
Фальсификация в России автомобильного топлива - национальная
традиция. Говорят, сейчас только в странах Западной Европы можно заправиться
настоящим бензином, отвечающим всем необходимым тр ...
Проблемы и решения на уровне учения о составе
Способ решения
основной проблемы химии - проблемы происхождения свойств веществ - стал
выражаться посредством схемы: СОСТАВ → СВОЙСТВА
Этот способ
положил начало учению о составе веществ, ...
Нестероидные противовоспалительные препараты. Салицилаты
...


