Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Кислотность и основность в газовой фазеОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Кислотность и основность в газовой фазе Кислотность и основность в газовой фазеСтраница 1
В 1960-х и 1970-х годах в результате развития новых масс-спектрометрических методов, в том числе метода ионного циклотронного резонанса и масс-спектрометрии высокого давления, появилась возможность исследовать перенос протона между двумя молекулами в газовой фазе, где нет никакой сольватации. В результате этих исследований неожиданно оказалось, что многие ряды относительной кислотности и основности в растворе, которые раньше легко объясняли собственными электронными и пространственными эффектами заместителей в молекулах, в газовой фазе полностью расстраиваются и даже обращаются, т.е. на самом деле связаны с сольватацией. В то же время обратили внимание на то, что ряды относительной реакционной способности в растворах часто обусловлены энтропийными, а не энтальпийными (энергетическими) эффектами (см. разд. 3.3.3,б). В данном разделе мы рассмотрим ряд удивительных результатов, полученных при изучении газофазной кислотности с целью обратить внимание на то, что эффекты сольватации часто могут перекрывать индуктивные, мезомерные и пространственные эффекты заместителей.
В газовой фазе сольватация отсутствует. Поэтому можно определить собственную кислотность молекул и путем сравнения с кислотностью в растворах выяснить, как влияет сольватация.
В качестве меры газофазной кислотности можно использовать взятую с обратным знаком энтальпию реакции присоединения протона к основанию, которая называется сродством к протону (П):
А- (газ) + Н+ (газ) → АН (газ), ΔНо= -П(А-);
В (газ) + Н+ (газ) → ВН+ (газ), ΔНо= -П(В)
Сродство к протону, взятое с положительным знаком, таким образом соответствует энтальпии диссоциации АН или ВН+.
В табл. 3.8 приведены значения сродства к протону для нейтральных молекул (В) и анионов. Видно, что в газовой фазе протон чрезвычайно экзотермично присоединяется к любой молекуле, включая даже метан. Более того, в газовой фазе протон присоединяется даже к молекулам благородных газов:
Не + Н+ → НеН+, ΔНо= -42 ккал/моль;
Хе + Н+ → ХеН+, ΔНо= -124 ккал/моль.
Эти данные показывают, насколько нестабилен несольватированный протон (и вообще несольватирвованные ионы): в газовой фазе он присоединяется к молекулам, имеющим не только неподеленные электронные пары (NH3, H2O, HF и др.), но и имеющим электроны лишь σ-типа (СН4). В последнем случае образуются трехцентровые двухэлектронные, так называемые "неклассические" ионы:
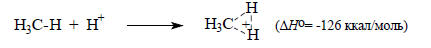
Таблица 3.8
Сродство к протону некоторых нейтральных молекул и анионов
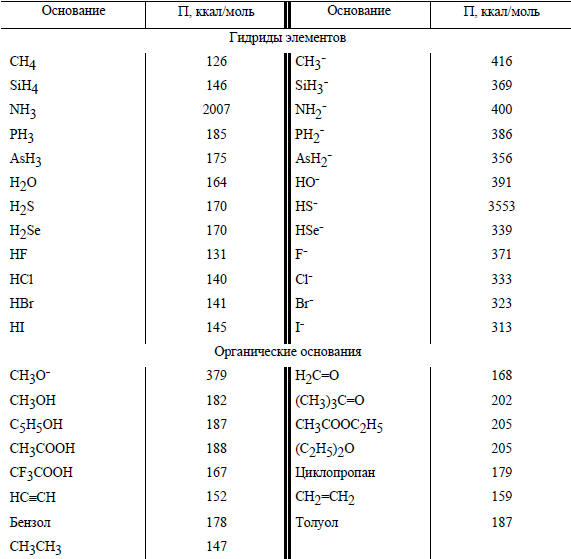
Особенно велико сродство протона к анионам (табл. 3.8), где рекорд принадлежит метильному аниону (ΔНо= -416 ккал/моль). Йодид-ион, слабейшее основание в воде (рКа(HI)≈-10), в газовой фазе оказывается значительно более сильным основанием, чем аммиак. В целом, сродство к протону в газовой фазе зависит от типа молекул следующим образом:

Вследствие очень низкой абсолютной кислотности молекул в газовой фазе прямую ионизацию АН→А-+Н+ изучают очень редко. Обычно определяют положение равновесия в реакции переноса протона между кислотой А1Н (или В1Н+) и каким-нибудь основанием А2- (или В2) и получают шкалу относительной кислотности. Чтобы перейти к абсолютной шкале кислотности в газовой фазе необходимо, по крайней мере для одной кислоты, измерить ΔG для процесса прямой ионизации. В качестве такой кислоты можно взять HF, для которого были получены следующие темодинамические данные:
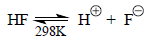
ΔHo(HF)=371 ккал/моль,
ΔSo(HF)=19 кал/K.моль,
ΔGo(HF)=366 ккал/моль.
Величина ΔGo=366 ккал/моль соответствует рКа(HF)=268 (уравнение (3.16)), тогда как в воде рКа(HF) составляет всего лишь 3,18 (табл. 3.2).
В табл. 3.9. приведены значения ΔSo, ΔHo и ΔGo для ионизации в газовой фазе. Видно, что изменение энтропии ΔSo ионизации невелико, и почти одинаково для всех кислот. Это означает, что величина ΔGo почти равна ΔHo, т.е. сродство к протону (П) достаточно верно характеризует абсолютную кислотность молекул Значения рКа в газовой фазе колоссально велики, независимо от того, HCl это или углеводород. В газовой фазе нет абсолютно сильных кислот; все кислоты слабые, поскольку протон и другие ионы в несольватированном состоянии существовать не склонны. Общий интервал изменения рКа в газовой фазе (ΔрКа=54 при переходе от NH3 к HNO3) не сильно отличается от интервала изменения рКа в воде (ΔрКа≅50 при переходе от толуола к HI).
Смотрите также
Дмитрий Иванович Менделеев – ученый с мировыми заслугами
Передо
мной стоит одна цель узнать и утвердить является ли Дмитрий Иванович Менделеев
ученым с мировыми заслугами. Для этого я использую различные материалы в виде
видеозаписей о жизни этог ...
Равновесия в неводных растворах
...
Иод
53
I
7 18 18 8 2
ИОД
126,904
5s25p5
...


