Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Функции кислотностиОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Функции кислотности Функции кислотностиСтраница 2
В серии из 14 замещенных нитроанилинов были проведены парные сравнения индикаторов B1/B2, B2/B3, ., B12/B13, B13/B14 (рис. 3.6,а) с постепенно уменьшающейся основностью от пара-нитроанилина (В1) до 2,4,6-тринитроанилина (В14), что позволило охватить очень широкий интервал концентрации кислоты от сильно разбавленной в случае пара-нитроанилина до 98%-ной - в случае тринитроанилина. В разбавленной кислоте γ≈1, и поэтому lg(γγBHB11+/)-lg(γγBHB22+/)=0. Из парной параллельности графиков (кривая для В1 практически параллельна кривой для В2, кривая для В2 параллельная кривой для В3 и т.д., однако при переходе от В1 к В14 параллельности не наблюдалось; см. рис. 3.6,а) следует, что этот член приблизительно равен нулю при всех концентрациях H2SO4, т.е. отношение γγBHB+/ зависит только от кислотности среды, но не от природы индикаторного основания. Это означает, что хотя истинные коэффициенты активности могут сильно изменяться при изменении среды, относительные свойства структурно подобных индикаторов остаются одинаковыми.
Чтобы получить интегральное представление о кислотности смесей Н2О/H2SO4 в интервале от 0 до 100% концентрации кислоты, нужно сдвинуть интегральные кривые на рис. 3.6,а вертикально вверх, чтобы они перекрылись между собой и образовали непрерывную линию. Эта линия изображена на рис. 3.6,б (Но).
Уравнение (3.18) теперь можно записать в виде
рКа(ВН+)=-lgho-lgI=Ho-lgI, (3.19)
где ho= и Но=-lgho. Параметр Но является мерой протонодонорной способности среды, и поэтому называется функцией кислотности. В разбавленном водном растворе ho=[Н3O+], т.е. ho=рН. В концентрированном растворе ho>>[HS+]. Например, в 50%-ной (≈`7,5 M) H2SO4 Но=-3,38 т.е. ho=4000. В 100%-ной (≈18,8 М) H2SO4 Но=-12,1, т.е. ho=1012,1. Такая большая кислотность концентрированной кислоты отражает тот факт, что в разбавленном растворе протон сильно гидратирован. Обычно гидратированный протон обозначают как Н3O+, но на самом деле в гидратации участвует большее число молекул воды, обычно четыре. Так, если экстрагировать сильную кислоту из водного раствора в органическую фазу, она обычно захватывает с собой четыре молекулы воды, а безводные кислотные ионообменные смолы легко поглощают 4 молекулы воды на один кислотный остаток.
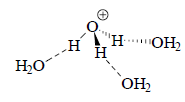
В концентрированной кислоте воды мало, сольватация протона неполная, и он очень склонен координироваться с другими основаниями.
При попарном сравнении индикаторов при одинаковой концентрации кислоты можно получить лишь разность между величинами рКа оснований:
pKa(B1H+)-pKa(B2H+)=lgI2-lgI1.
Следовательно, чтобы получить абсолютные значения pKa(BH+), нужно начинать сравнения с достаточно основного индикатора, для которого можно измерить pKa в разбавленном водном растворе. В качестве такого основания Гаммет выбрал пара-нитроанилин (pKa=0,99; см. табл. 3.3). Тогда для 2,4-динитроанилина pKa=-4,53, а для 2,4,6-тринитроанилина pKa=-10,1.
Суперкислые среды. Высокое отрицательное значение кислотной функции означает, что данная кислотная среда обладает сильной протонодонорной способностью. Если протонодонорная сила кислотной среды равна или превышает протонодонорную силу 100%-ной серной кислоты, то такие среды называются суперкислыми. В табл. 3.7 приведены значения Но для одиннадцати кислот и кислотных систем, восемь из которых сильнее 100%-ной H2SO4. Суперкислые среды широко используются в органической химии для генерации и спектрального исследования алкильных карбокатионов (R+), аренониевых ионов (ArH2+), ионов алкония (AlkH2+) и других частиц, имеющих повышенную склонность к реакциям с нуклеофилами.
Таблица 3.7.
Значения Но для некоторых кислот и кислотных систем

Смотрите также
Полимерные композиты на основе диальдегилцеллюлозы и полигуанилинметакрилата
Среди
полимеров, нашедших широкое применение в различных областях жизнедеятельности
человека, важное место занимает целлюлоза, как постоянно возобновляемый в
природе полимер, и ее производн ...
Риформинг как способ получения бензинов с улучшенными характеристиками
Бензины являются
одним из основных видов горючего для двигателей современной техники.
Автомобильные и мотоциклетные, лодочные и авиационные поршневые двигатели
потребляют бензины. В настоящ ...
Концентрация растворов.
Цель работы - приобретение
навыков приготовления растворов различной концентрации из сухой соли или более
концентрированного раствора.
Приведем
несколько примеров расчета по теме "Концент ...


