Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Функции кислотностиОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Функции кислотности Функции кислотностиСтраница 1
Кислотность в разбавленных водных растворах выражается величиной рН. Пользуясь таблицами значений рКа кислот (см. табл. 3.2) и оснований (см. табл. 3.3), с помощью уравнения (3.15) (для ионизации оснований в этом уравнении индекс АН нужно заменить на ВН+, а индекс А- на В) легко вычислить, что, например, при рН=7 фенол (рКа=10) диссоциирован на 0,1% ([A]/[HA]=10-3), а анилин (рКа=4,6) протонирован на 0,4% ([B]/[BH+]=251).
Аналогично можно рассчитать, что амфотерный 8-оксихинолин, который может вести себя и как кислота:
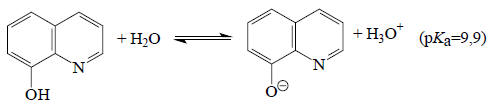
и как основание
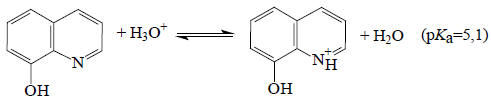
при рН около 7,5 не будет ни протонироваться, ни депротонироваться, т.е. будет находиться в нейтральной форме, тогда как, например, при рН=4,4 84% молекул 8-оксихинолина будут существовать в виде катиона, и при рН=10,9 91% молекул будет существовать в виде аниона. Такие термодинамические расчеты, безусловно, практически полезны.
Очень слабые кислоты в ощутимой степени ионизируются лишь в концентрированных растворах оснований, так же как очень слабые основания протонируются лишь в концентрированных растворах кислот. Для концентрированных растворов уравнение (3.15) неприменимо, так как оно было выведено при условии, что коэффициенты активности равны единице (см. разд. 3.3.2). Уравнение (3.15) нельзя применять также для неводных растворов. В 1932 г. Гаммет и Дейрап предложили использовать для концентрированных растворов серной кислоты вместо рН эмпирическую функцию кислотности, обозначенную символом Но ("аш ноль"). Для ионизации слабого основания В (В + Н+ ВН+) величина рКа (ВН+) определяется следующим выражением (ср. разд. 3.3.2):
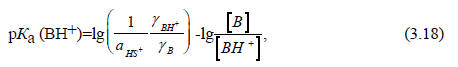
где γ - коэффициент активности; аHS+ - активность сольватированного протона.
Величину аHS+, в принципе, всегда можно измерить, но определить коэффициенты γ очень сложно, тем более, что они меняются в зависимости от среды. Гаммет и Дейрап для решения этой проблемы использовали серию индикаторных основания (замещенные в кольце анилины), электронные спектры которых сильно отличались от спектров соответствующих сопряженных кислот, и поэтому отношение [B]/[BH+] (уравнение(3.18)) можно было легко измерить спектрофотометрически или колориметрически. Величину [B]/[BH+] принято обозначать символом I; она называется индикаторным отношением.
Рассмотрим два основания - В1 и В2, растворенные в серной кислоте одной и той же концентрации, чтобы для обоих растворов были одинаковы. Если индикаторы В1 и В2 взяты в очень низкой концентрации, их влиянием на данную среду можно пренебречь. (Для практических целей нужно использовать В1 и В2, имеющие близкие рКа, чтобы для данного раствора оба индикаторных отношения - I1 и I2 - лежали в области, где их можно точно измерить, например от I=0,1 до I=10). Вычитая уравнение (3.18) для В2 из уравнения (3.18) для В1, получаем
рКа(ВН+)=lg(γγBHB11+/)-lg(γγBHB22+/)+lgI2-lgI1,
где I1 и I2 - индикаторные отношения для В1 и В2, соответственно. Экспериментально измерив значение I для различных пар слабо основных анилинов, взятых в качестве индикаторов, Гаммет обнаружил, что для близких по основности В1 и В2 графики зависимости lgI1 и lgI2 от концентрации H2SO4 оказались практически параллельными друг другу (рис. 3.6,а). Это означает, что ΔlgI=lg(γγBHB11+/)-lg(γγBHB22+/) не зависит от аHS+ и, следовательно, lg(γγBH1+B1/)-lg(γγBH2+B2/) также не зависит от аHS+.
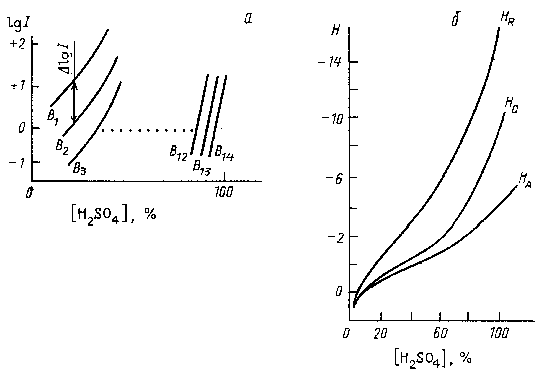
Рис. 3.6. Зависимость индикаторных отношений от концентрации сетной кислоты (а) и общий вид функций кислотности НА, НО и НВ (б)
Смотрите также
Свойства вулканизаторов
Механические свойства
резин из фторкаучуков существенно зависят от состава смеси и метода
вулканизации. Например резины полученные радиационной вулканизацией,
превосходят перекисные по теплостойкос ...
Алкилирование бензола производными циклических углеводородов
...


