Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Влияние растворителя на кислотно-основное равновесие. Термодинамика
химических превращенийОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Влияние растворителя на кислотно-основное равновесие. Термодинамика
химических превращений Влияние растворителя на кислотно-основное равновесие. Термодинамика
химических превращенийСтраница 2
ΔSТ0=(сумма SТ0 продуктов - сумма SТ0 реагентов).
Энтропию измеряют калориметрически из зависимости теплоемкости соединений или элементов от температуры. Это гораздо более сложный эксперимент, чем определение ΔH.
В основном электронном состоянии энтропия любого элемента, молекулы, кристалла и т.д. может быть представлена суммой трех слагаемых:
S=Sпост+Sвращ+Sкол,
где Sпост - энтропия, связанная с поступательным движением молекул (мера рассеивания частиц по объему раствора в колбе);
Sвращ - энтропия, связанная с внутренним вращением вокруг σ-связей в молекуле и с вращением всей молекулы как целого волчка;
Sкол - энтропия, связанная с колебаниями атомов в молекуле (растяжение и сжатие связей, деформационные колебания и т.д.).
Если в результате реакции увеличивается общее число частиц по сравнению с их числом до реакции, то энтропия поступательного движения возрастает [ΔSпост=ΔSпост, продукты-ΔSпост, реагенты>0], если число частиц уменьшается, то ΔSпост<0, если число частиц не изменяется, то ΔSпост≈0.
Например:
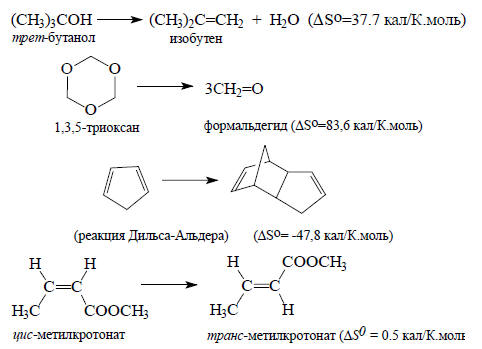
Последний пример показывает, что при изомеризациях энтропия поступательного движения не изменяется.
Если в продукте реакции возникают возможности для более свободных колебаний атомов, то колебательная энтропия возрастает. Например:
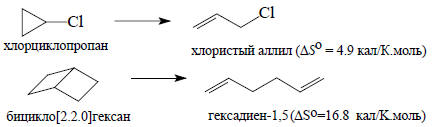
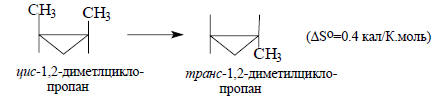
Однако когда продукты реакции очень похожи на реагенты, энтропия почти не изменяется, поскольку как Δ, так и ΔSкол приблизительно равны нулю.
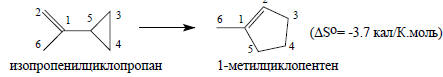
Уменьшение энтропии в приведенной ниже реакции изомеризации объясняется тем, что в продукте реакции внутреннее вращение вокруг связи С1-С5 невозможно, а в реагенте возможно, хотя и заторможено большими размерами циклопропильной группы.
Для расчета энтропии, связанной с вращением целой молекулы, необходимо определить ее момент инерции и число симметрии σ (т.е. число неразличимых ситуаций, которое можно получить вращением молекулы как целого; например, для HCl σ=1, для Br2 σ=2, для этилена σ=4, для этана σ=6 и т д.). Момент инерции рассчитывают из длин связей и углов между связями, которые экспериментально определяют по данным дифракции электронов и молекулярной спектроскопии. Для больших, гибких органических молекул такие расчеты очень затруднительны.
Приведенные выше значения ΔSо для разных реакций, а также расчеты вкладов в общую энтропию, которые возможны для простых молекул, показывают, что во всех случаях
Sпост > Sвращ > Sкол


