Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
ВведениеОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Введение ВведениеСтраница 2
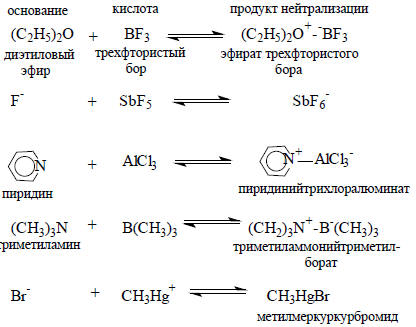
При анализе возможных путей реакции иногда бывает полезно мысленно делить молекулу на два фрагмента, один из которых является кислотой, а другой - основанием Льюиса. Такое гетеролитическое рассечение молекул не обязательно будет соответствовать в действительности протекающей химической реакции, однако из него можно выяснить, из каких кислотных и основных фрагментов в принципе можно составить данную молекулу:
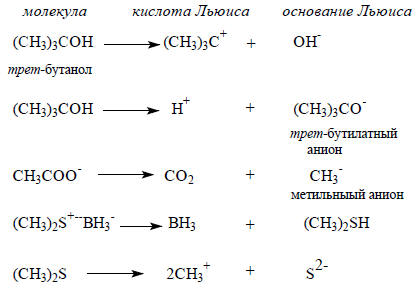
Любую сложную молекулу можно рассечь на разные фрагменты. некоторые молекулярные фрагменты, например, алкильные группы или галогены, могут быть или кислотами или основаниями Льюиса, в зависимости от заполненности электронами их валентных оболочек. Это связано в направлением гетеролиза при генерировании фрагментов, например:
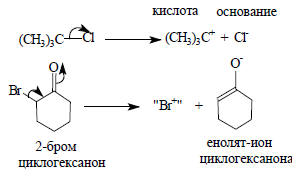
Определив кислоты Льюиса как акцепторы электронной пары, можно прийти к выводу, что таких молекул должно существовать огромное множество. К ним должны относиться катионы металлов, органические катионы (например, t-Bu+), нейтральные соли металлов (ZnCl2, AlCl3 и т.д.), металлоорганические соединения (RMgX, R4Sn), соединения бора (BF3, BH3, R3B) и т.п.
Большинство кислот Льюиса представляют собой многоэлектронные молекулы или катионы, однако протон, который также относится к кислотам Льюиса, не имеет ни одного электрона. Кроме того, протон очень мал по размерам и, следовательно, способен очень быстро двигаться, т.е. кислотно-основные реакции в участием протона часто могут идти очень быстро. Таким образом, протон среди кислот должен занимать особое место. Выделение протона из всех кислот Льюиса обусловлено также и его особой ролью в органической химии и биохимии. В этой и последующей главах будет приведено множество примеров, показывающих, что очень часто органические реакции включают стадии перемещения протона внутри одной молекулы или от одной молекулы к другой (например, к молекуле растворителя). Протон является также исключительно эффективным катализатором многих реакций, происходящих в гидроксилсодержащих растворителях (воде, спиртах, карбоновых кислотах и т.п.), например, гидролиза простых и сложных эфиров, этерификации карбоновых кислот, гидратации олефинов, альдольной конденсации и многих других. Особая роль протона как кислоты подчеркивается в теории кислот и оснований Бренстеда. Главное отличие теории кислот и оснований Бренстеда от теории Льюиса заключается в том, что кислотой Бренстеда АН является соединение, которое может выступать в качестве донора протона; акцептор протона В называется основанием Бренстеда:
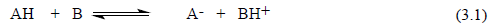
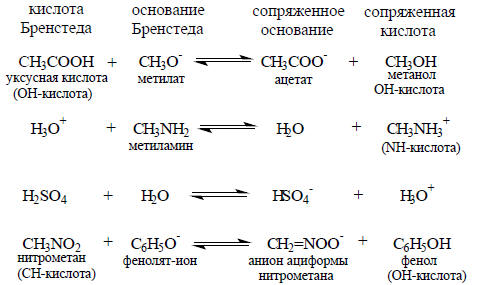
В обратной реакции основанием является А-, а кислотой ВН+, поэтому А- называют сопряженным основанием кислоты АН, а ВН+ - сопряженной кислотой основания В.
В большинстве органических соединений обязательно содержится водород. Следовательно, по крайней мере потенциально, почти все органические соединения являются кислотами Бренстеда. В зависимости от того, с каким элементом в молекуле связан атом водорода (O, N, S или С) различают ОН-кислоты, NH-кислоты, SH-кислоты, СН-кислоты и т.д.
Кислоты и основания Бренстеда могут быть заряженными или нейтральными, например:
Смотрите также
Свойства элементов VA и VIA.
Цель
работы:
изучение химических свойств элементов - азота, фосфора, кислорода и серы.
Азот
и фосфор являются элементами VA группы периодической системы. На внешнем
энергетическом уровне атомов ...
Обмен углеводов
Биосинтетические процессы,
протекающие в клетках, нуждаются не только в энергии, им необходимы также
восстановительные эквиваленты в виде НАДФН+Н + и целый ряд
моносахаридов, имеющих в свое ...


