Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
ВведениеОрганическая химия / Кислоты и основания / Органическая химия / Кислоты и основания / Введение ВведениеСтраница 1
Как правило, органические реакции являются сложными многостадийными процессами, состоящими из последовательности простых (элементарных) реакций. Эти элементарные реакции обычно делят на три категории. К первой категории относятся различные изомеризации и перегруппировки, в которых изомер А переходит в изомер В:
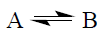
Вторая категория включает рекомбинацию молекул или ионов А и В или диссоциацию молекулы АВ на фрагменты А и В:
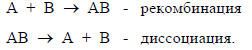
Наконец, к третьей категории относятся бимолекулярные процессы замещения:
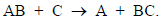
Большинство из перечисленных категорий реакций (кроме некоторых видов изомеризации и процессов диссоциации) начинается с возникновения внутри- и межмолекулярных донорно-акцепторных взаимодействий; диссоциация начинается с ослабления донорно-акцепторного взаимодействия между А и В, существовавшего в молекуле АВ до реакции. В разделе 2.3.2 (гл. 2) мы уже упоминали, что в донорно-акцепторном комплексе акцепторную молекулу можно рассматривать как кислоту, а донорную молекулу - как основание, и следовательно, образование этого комплекса соответствует нейтрализации кислоты основанием. Точно так же любую устойчивую молекулу можно рассматривать как продукт соединения двух фрагментов: кислоты и основания, и если в реакции происходят диссоциация на эти фрагменты, то, по существу, эта реакция является процессом, обратным реакции нейтрализации.
История возникновения и развития представлений о кислотно-основном взаимодействии как основе химических реакций насчитывает более 300 лет. В XVII в. Р.Бойль считал, что кислоты - это тела, атомы которых имеют острые выступы (поэтому они имеют кислый вкус), а основания - это тела, атомы которых имеют поры (вяжущий вкус), и реакция нейтрализации сводится к тому, что выступы кислоты входят в поры основания. В XVIII в. Лавуазье в поисках "кислотной сущности" пришел к выводу, что в кислотах обязательно должен содержаться элемент О (отсюда русское название элемента "кислород", немецкое Sдuerstoff и т.д.). Но Дэви, в течение 15 лет искавший в соляной кислоте кислород, строго доказал, что в HCl кислорода нет. В конце XIX и начале XX вв. господствовала электрохимическая теория кислот и оснований Аррениуса и считалось, что существует только одна кислота - протон и только одно основание - гидроксильный анион, а основные свойства таких молекул, как NH3 можно объяснить тем, что при растворении в воде образуются ионы ОН- и NH4+.
В 1920-х годах практически одновременно Льюис и Бренстед выдвинули свои теории кислот и оснований, которыми в настоящее время пользуются практически все химики. В 1960-х годах Пирсон дополнил теории Льюиса и Бренстеда, предложив использовать представления о "жестких" и "мягких" кислотах и основаниях. Эти представления хорошо обоснованы квантовой химией; таким образом, чисто химические понятия "кислота" и "основание" в настоящее время получили физическое содержание.
Основание Льюиса - это молекула (или анион), которая является донором электронной пары. Как правило, в образовании ковалентной связи с другой молекулой (или катионом) принимает участие несвязывающая (неподеленная) пара электронов основания. Другая молекула (или катион), с которой образует связь основание, является акцептором электронной пары и называется кислотой Льюиса. Обычно кислоты Льюиса первоначально имеют на два электрона меньше числа, соответствующего заполненной валентной оболочке (6 вместо 8). Ниже приведены примеры Льюисовых кислотно-основных реакций:
Смотрите также
Растворение твердых веществ
Тема контрольной работы
«Растворение твердых веществ» по дисциплине «Химическая
технология неорганических веществ».
Под термином растворение
понимают гетерогенные реакции, протекающие ме ...


