Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Плоскостные σ-орбитали малых циклов. ЦиклопропанОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Плоскостные σ-орбитали малых циклов. Циклопропан Плоскостные σ-орбитали малых циклов. ЦиклопропанСтраница 1
Молекулу циклопропана можно рассматривать как состоящую из трех метиленовых единиц ("строительных блоков"), каждая из которых имеет орбитали, используемые для образования связей С-Н (на схеме не показаны), и, кроме того, nσ- и nπ-орбитали, используемые для образования скелетных связей С-С:
nπ-Орбитали по энергии расположены немного выше nσ -орбиталей. Форма скелетных плоскостных орбиталей и последовательные стадии их построения, включающие первоначальное объединение двух атомов и последующее присоединение третьего атома углерода, показаны на рис. 2.29. Расщепление уровней (рис. 2.29,а) соответствует общему правилу, согласно которому самую низкую энергию имеют σ-орбитали, а самую высокую энергию - орбитали σ*-типа; между ними располагаются π- и π*-орбитали.
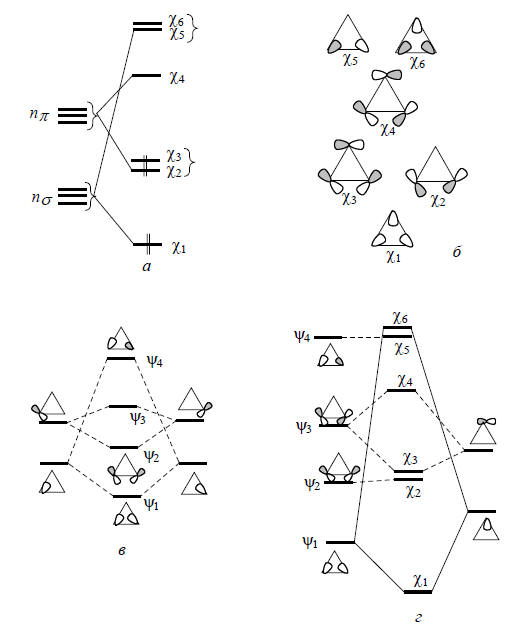 Рис. 2.29. Расщепление nσ- и nπ-орбиталей при образовании скелетных плоскостных орбиталей циклопропана (а); форма орбиталей (б) и последовательные стадии построения орбиталей цикла (в и г).
Рис. 2.29. Расщепление nσ- и nπ-орбиталей при образовании скелетных плоскостных орбиталей циклопропана (а); форма орбиталей (б) и последовательные стадии построения орбиталей цикла (в и г).
Более строгая форма скелетных циклопропановых орбиталей получается при учете того факта, что орбитали χ5 и χ6 имеют ту же симметрию, что и орбитали χ2 и χ3. Следовательно, они смешиваются друг с другом, что показано ниже:
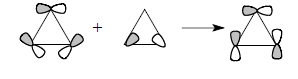
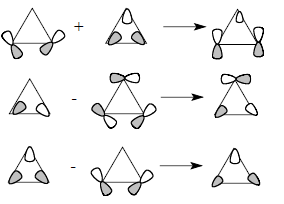
Орбитали циклопропана не имеют четко выраженного направления вдоль межъядерной линии С-С, и связи С-С поэтому называются "банановыми" (гл. 24). Плоскостные σ-орбитали (рис. 2.29,б) соответствуют трем С-С-связям цикла, и каждая из связывающих орбиталей χ1, χ2 и χ3 занята парой электронов. Орбитали χ2 и χ3 лежат выше, чем обычные σсс-орбитали, например, в этане. Они почти целиком построены из р-орбиталей атома углерода, лежащих в плоскости цикла. Эти р-орбитали в отличие от циклоалканов с большими размерами цикла направлены друг к другу не по линии С-С-связей. Следовательно, вырожденные уровни χ2 и χ3, в принципе, должны быть хорошими электронодонорами по отношению к заместителям в трехчленном цикле. По той же причине орбиталь χ4 (НСМО) должна обладать хорошими акцепторными свойствами. Три С-С-связи в циклопропане эквивалентны, поскольку орбитали в паре χ2/χ3 заняты. Однако орбиталь χ2 и χ3 по-разному взаимодействуют с заместителями в кольце. Например, диметил-циклопропильный карбокатион более стабилен в конформации (А), чем в кон-формации (Б), причем барьер вращения между этими двумя формами очень вы-сок (∼14 ккал/моль по данным ЯМР).Этот факт очень легко объяснить взаимо-действием карбокатионной р-орбитали с циклопропановой орбиталью χ3:
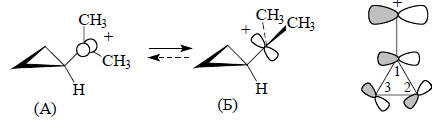
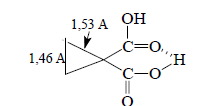
Результатом такого взаимодействия является ослабление связей С(1)-С(2) и С(1)-С(3) и усиление связи С(2)-С(3) в производных циклопропана, содержащих хорошие электроноакцепторные заместители (CR2, -C≡N, -COOR), что выражается в удлинении связей С(1)-С(2) и С(1)-С(3) и укорочении связи С(2)-С(3). Типичный пример приведен ниже:
Аналогично, можно легко понять, почему положение равновесия норкарадиен - гептатриен сдвинуто в сторону норкарадиена при наличии сильных электроноакцепторных заместителей R:
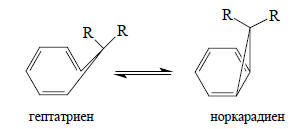
Циклопропильный фрагмент норкарадиена стабилизируется электроноакцепторными группами. Если R=H, то соединение существует только в циклогептатриеновой форме, но если R=CN, равновесие сдвинуто в сторону норкарадиена.Орбиталь χ2 (вторая вырожденная ВЗМО) отвечает за протонирование циклопропана "по ребру":
Смотрите также
Легко- и трудногидролизуемые полисахариды
Определение легко - и трудногидролизуемых
полисахаридов в древесине основано на реакциях их гидролиза с последующим
нахождением общего количества образовавшихся моносахаридов по редуцирующей ...
Создание новых лекарственных веществ
Несмотря на достижения
современной анестезии, продолжаются поиски менее опасных средств для наркоза,
разработка различных вариантов многокомпонентного избирательного наркоза,
позволяющего з ...
Разработка основ технологии и оборудования для электрохимического производства нитрата графита
...


