Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
Молекулярные орбитали метанаОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / Молекулярные орбитали метана Молекулярные орбитали метанаСтраница 1
Если в центр тетраэдрического ансамбля из четырех атомов водорода поместить атом углерода, то образуется молекула метана. На рис. 2.19 приведена диаграмма взаимодействия атомных орбиталей углерода с групповыми орбиталями ансамбля Н4.
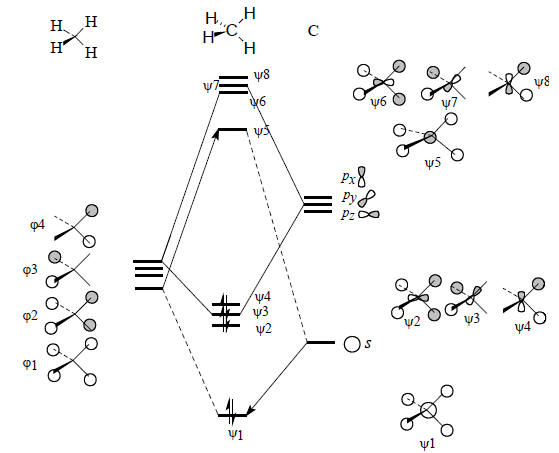 Рис. 2.19. Диаграмма орбитального взаимодействия для молекулы метана.
Рис. 2.19. Диаграмма орбитального взаимодействия для молекулы метана.
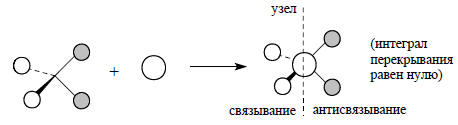
При построении этой диаграммы используется правило, согласно которому взаимодействовать могут только орбитали одинаковой симметрии. Например, орбиталь 2s атома углерода (без узлов) может комбинироваться лишь с групповой орбиталью ϕ1 (тоже без узлов), так как ее комбинация с любой другой из групповых орбиталей приводит к ситуации, когда интеграл перекрывания равен нулю, поскольку все другие орбитали Н4 имеют узловые плоскости, и вследствие этого связывание по одну сторону узла компенсируется антисвязыванием по другую сторону узла, например:
На рис. 2.19 справа приведены графические изображения восьми орбиталей метана, полученные путем такого подбора по симметрии пар взаимодействующих орбиталей. В соответствии с узловыми свойствами орбиталей метан должен иметь одну сильно связывающую орбиталь σ-типа (ψ1), три вырожденные, менее сильно связывающие орбитали π-симметрии (ψ2, ψ3 и ψ4), а также слабо разрыхляющую пустую σ*-орбиталь (ψ5) и три вырожденные, сильно разрыхляющие пустые π*-орбитали (ψ6, ψ7 и ψ8). Эта картина согласуется с контурными изображениями, приведенными на рис. 1.15 (гл. 1).Рис. 2.19 дает представление о симметрии и узловых свойствах молекулярных (делокализованных по всей молекуле) орбиталей метана. Если же исходить из представлений об орбиталях отдельных связей, то нужно взять sp3-гибридные орбитали атома углерода (разд. 1.8, гл. 1) и скомбинировать их в фазе и противофазе с 1s-орбиталями атома водорода. Тогда получим четыре вырожденные связывающие орбитали четырех связей С-Н (оси) и четыре вырожденные антисвязывающие орбитали (σ*СН):
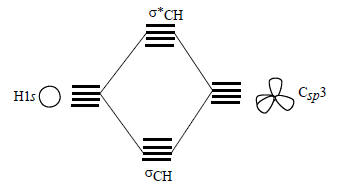
В локализованной sp3-модели орбитали метана выглядят следующим образом.Четыре связывающие орбитали равной энергии:

Четыре антисвязывающие орбитали равной энергии:
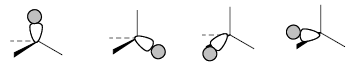
Из этой модели следует, что метан должен иметь один потенциал ионизации, хотя на самом деле их два (см. гл. 1, разд. 1.9). Последнее хорошо согласуется с делокализованной канонической моделью (см. рис.2.19). Чтобы гибридизованную модель привести в соответствие с этими данными, поступают следующим образом: четыре sp3-гибридные орбитали атома углерода симметризуют в соответствии с требованиями точечной группы симметрии тетраэдра Td. В результате получают четыре симметризованные орбитали центрального атома углерода, которые комбинируют с четырьмя групповыми орбиталями тетраэдрического ансамбля Н4 (рис. 2.20).
Смотрите также
Выполнение лабораторных работ по химии в вузах
...
Производство уксусной кислоты
Уксусная кислота — первая из органических кислот, которая стала известна
человеку. Впервые она была получена И.Глаубером в 1648 г. и в концентрированном виде путем вымораживания ее водных рас ...


