Меню сайта
Наши новости
Распространение алкалоидов в растительном мире.
Умягчение воды
π-Системы, содержащие гетероатомОрганическая химия / Внутри- и межмолекулярные взаимодействия / Органическая химия / Внутри- и межмолекулярные взаимодействия / π-Системы, содержащие гетероатом π-Системы, содержащие гетероатомСтраница 1
Энергия возмущения выражается в единицах β и отсчитывается от стандартного уровня αС, который соответствует одиночной углеродной 2р-орбитали (поэтому индекс С) и называется несвязывающим уровнем. Однако, если мы переходим от чисто углеродных π-систем к системам, содержащим гетероатом, например, от этилена СН2=СН2 к формальдегиду СН2=О, от аллильного аниона СН2=СН-СН2- - к енолят-аниону ацетальдегида СН2=СН-О- или от бутадиена СН2=СН-СН=СН2 - к акролеину СН2=СН-СН=О, то кроме αС появляется второй уровень - αО, который соответствует одиночной 2р-орбитали атома кислорода. Поскольку αС ≠αО (уровень αО лежит ниже, так как кислород более электроотрицательный элемент, чем углерод), при образовании π-орбитали карбонильной группы >С=О происходит возмущение второго порядка (рис. 2.13).При возмущении второго порядка связывающая орбиталь напоминает более низко расположенную базисную невозмущенную орбиталь (см. разд. 2.5.3). Это выражается в коэффициентах и распределении электронной плотности. В этилене коэффциенты на обоих атомах углерода одинаковы (1/2, рис. 2.5), но в формальдегиде Cc<Co, a Cс*>Co*, причем Cc/Co= Cс*/ Co*. Это эквивалентно утверждению, что пара электронов на связывающей орбитали π «смещена» к атому кислорода, и на кислороде π- электронный заряд отрицательнее, а на углероде положительнее, чем в нейтральной молекуле этилена: Н2С=СН2, Н2Сδ+=Oδ− этилен формальдегид С другой стороны, плотность антисвязывающей орбитали π* больше на атоме углерода, чем на атоме кислорода.
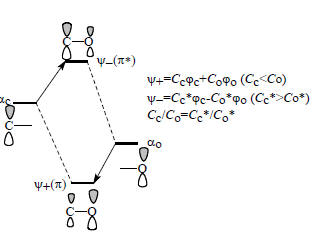 Рис. 2.13. Возмущение второго порядка при образовании π-связи карбонильной группы. Между ψ+ и ψ- находятся несвязывающие орбитали неподеленных пар электронов атома кислорода.
Рис. 2.13. Возмущение второго порядка при образовании π-связи карбонильной группы. Между ψ+ и ψ- находятся несвязывающие орбитали неподеленных пар электронов атома кислорода.
Необходимо иметь в виду, что орбиталь π не является высшей занятой МО карбонильной группы. У атома кислорода имеются две неподеленные пары электронов, которые занимают несвязывающие орбитали (почти вырожденные). Именно эти орбитали и будут ВЗМО. Локализация их на кислороде увеличивает общий отрицательный заряд на этом атоме. Реакции с электрофилами (например, с Н+) идут с участием как раз этих насвязывающих МО:
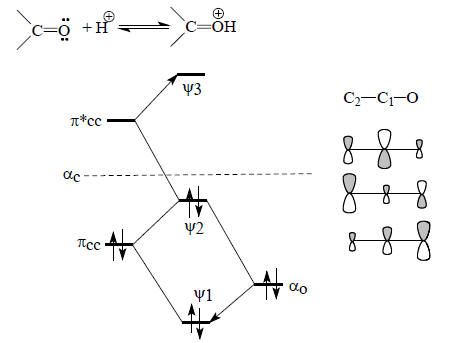 Рис. 2.14. π-Орбитали енолят-аниона ацетальдегида.
Рис. 2.14. π-Орбитали енолят-аниона ацетальдегида.
π-Система енолят-аниона (рис. 2.14) родственна аллильной π-системе (см. рис. 2.6). Связывающая π-орбиталь ψ1 в основном принадлежит атому кислорода в полной аналогии с соответствующей орбиталью карбонильной группы (рис. 2.13); она расположена очень низко, поскольку оба возмущения, как со стороны орбитали πСС этиленового фрагмента, так и со стороны орбитали π*СС, понижают уровень О2р. Орбиталь πСС расположена ближе к О2р, чем орбиталь π*СС, и поэтому взаимодействует с О2р сильнее, чем π*СС. Это можно выразить следующей схемой:
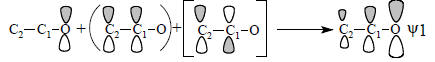
Смысл схемы состоит в том, что орбиталь ψ1 образуется из орбитали О2р путем смешивания ее с орбиталями πСС и π*СС в фазе (знак «плюс»). Орбиталь ψ1 по форме и по энергии похожа в первую очередь на О2р, во вторую очередь - на πСС и имеет лишь слабое сходство с π*СС. Действительно, π*СС имеет узел между С1 и С2, а ψ1 такого узла не имеет. Влияние π*СС на форму орбитали ψ1 угадывается лишь в том, что коэффициент при С2 меньше, чем при С1, так как π*СС подмешивается к πСС в области атома С2 в противофазе, а в области атома С1 - в фазе соответствующих р-функций.Орбитали ψ2 и ψ3 образуются следующим образом:
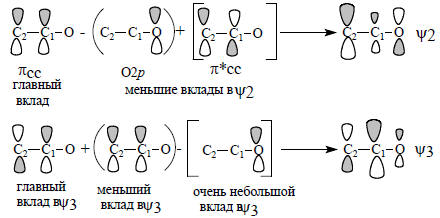
Орбиталь ψ2 расположена ниже уровня αС, но выше уровня αО. Поэтому между С1 и С2 имеется связывание, а между С1 и О - антисвязывание. Орбиталь ψ2 нельзя рассматривать в полном смысле как несвязывающую (в отличие от ψ2 аллила), так как коэффициент центрального атома С1 не равен нулю, но тем не менее коэффициент при очень мал (рис. 2.14), и поэтому реакции электрофилов по атому С1 маловероятны. И действительно, все реакции амбидентных анионов с электрофильными агентами идут или по О, или по С2 (гл. 17). Важным обстоятельством является тот факт, что в орбиталь ψ2 главный вклад вносит атом углерода С2, а не атом кислорода. Если учесть, что орбитали неподеленных пар электронов атома кислорода лежат ниже ψ2 (так как αО ниже ψ2; см. рис. 2.14), то можно прийти к заключению, что в реакциях с электрофилами, в которых важен орбитальный контроль, будет происходить атака по С2, а в реакциях с зарядовым контролем - атака по О (см. разд. 2.3.7), поскольку на атоме кислорода отрицательный заряд больше, чем не атоме углерода, из-за того что он имеет неподеленные пары, и, кроме того, нижняя занятая орбиталь ψ1 в основном принадлежит кислороду и лишь слабо делокализована по атомам углерода (см. рис. 2.14) Пустая орбиталь енолят-иона ψ3 локализуется в основном на С1, поэтому по С1 могла бы идти атака нуклеофилами. Однако енолят-анионы не склонны реагировать с нуклеофилами из-за того, что сами имеют отрицательный заряд, т.е. сами являются сильными нуклеофилами.Теперь обратим внимание на то, каковы коэффициенты, с которыми атомы О, С1 и С2 входят в данную орбиталь и в разные орбитали. При качественном рассмотрении будем называть эти коэффициенты «большой», «средний» и «небольшой» в соответствии с размерами р-АО на рис. 2.14. Можно составить следующую таблицу (табл. 2.7).
Смотрите также
Анализ биологических тканей и жидкостей
Химия всегда была
связана с медициной, а в XVI-XVII в.в. практически целиком
«работала» на нее (период ятрохимии). Многие химики тех времен были по
образованию, а иногда и по роду занятий, ...
Полимераналогичные превращения бутадиен-стирольных каучуков
Под реакциями полимеров понимают все химические превращения
заранее образовавшихся макромолекул. Эти реакции могут протекать с сохранением,
увеличением или уменьшением степени полимеризации. ...
Разработка дополнительных занятий в школе к теме "Химизм различных способов приготовления пищи"
Проблема пищи всегда
была одной из самых важных проблем, стоящих перед человеческим обществом.
Все, кроме кислорода,
человек получает для своей жизнедеятельности из пищи. Среднее потребле ...


